發布時間:2020-02-24所屬分類:醫學論文瀏覽:1次
摘 要: 摘要背景:如何增強骨髓間充質干細胞增殖活性使其移植后發揮應有的療效是目前急需解決的問題。 目的:探討體外負壓培養技術對小鼠骨髓間充質干細胞增殖活性及血管內皮生長因子分泌水平的影響。 方法:取第 3 代骨髓間充質干細胞,給予間歇性負壓培養(-6.65,
摘要背景:如何增強骨髓間充質干細胞增殖活性使其移植后發揮應有的療效是目前急需解決的問題。
目的:探討體外負壓培養技術對小鼠骨髓間充質干細胞增殖活性及血管內皮生長因子分泌水平的影響。
方法:取第 3 代骨髓間充質干細胞,給予間歇性負壓培養(-6.65,-13.3,-26.6 kPa),2 h/次,1 次/12 h,對照組在正常條件下培養。培養 12,24,36,48,60 h,采用 CCK-8 法檢測細胞增殖情況,ELISA 檢測細胞分泌血管內皮生長因子水平,RT-PCR 檢測血管內皮生長因子受體 mRNA 表達。根據上述結果,選擇一個最佳負壓條件和時間(-26.6 kPa,24 h),將骨髓間充質干細胞分為正常對照組、負壓組、負壓+血管內皮生長因子受體抑制劑 Axitinib 組,CCK-8 法檢測細胞增殖情況,EDU 試劑盒檢測 EDU 細胞陽性率,結晶紫染色觀察細胞集落形成單位。結果與結論:①與對照組比較,3 個負壓干預組骨髓間充質干細胞顯著增殖(P < 0.05);②與對照組比較,3 個負壓干預組細胞分泌血管內皮生長因子水平顯著增高(P < 0.05),血管內皮生長因子受體 mRNA 表達顯著增高(P < 0.05);③經血管內皮生長因子受體抑制劑處理后,細胞增殖吸光度值、克隆形成單位數量及 EDU 陽性細胞率較負壓干預組明顯降低;④結果表明,體外負壓培養可能通過上調血管內皮生長因子分泌水平促進骨髓間充質干細胞增殖。
關鍵詞:骨髓間充質干細胞;負壓培養;細胞增殖;血管內皮生長因子;血管內皮生長因子受體;克隆形成單位
0 引言 Introduction
德國病理學家Cohnheim在研究傷口愈合時首次提出骨髓中存在非造血干細胞的觀點,并指出成纖維細胞可能來源于骨髓[1]。FRIEDENSTEIN在20世紀60年代的一系列研究中證實了骨髓中的細胞能夠附著在組織培養板的表面,并能形成骨骼組織,包括骨和軟骨。除骨髓之外,在其他許多組織中也存在這種細胞,如外周血、脂肪組織、羊膜和臍血等[2-3]。骨髓間充質干細胞具有增殖和分化為多種細胞的潛能,已成為組織工程和再生醫學中一種很有前景的細胞來源[4-5]。一方面,骨髓間充質干細胞經培養擴增后移植到體內或種植于三維生物材料支架中,能夠形成新的組織,為臨床應用做準備[6-7];另一方面,骨髓間充質干細胞移植到體內,能夠分泌胰島素樣生長因子、血管內皮生長因子、轉化生長因子β1等營養因子[8]。例如,骨髓間充質干細胞移植治療急性心肌梗死,有助于提高瘢痕心肌的順應性,改善心功能[9-10]。LIAO等[11]研究表明,骨髓間充質干細胞通過免疫調節和旁分泌效應促進血管生成,改善心力衰竭患者心臟功能。
心力衰竭患者心臟功能。雖然以骨髓間充質干細胞為基礎的治療方法有望用于疾病的治療,但在該細胞能夠廣泛應用于臨床之前,仍然存在一些挑戰。首先,骨髓間充質干細胞僅占骨髓單個核細胞的0.01%,從骨髓中獲取細胞后,需要對其進行擴增才能獲得足夠數量的細胞,以供后續應用,例如,大多數組織工程應用都需要數百萬間充質干細胞;其次,干細胞移植后存活率低,即絕大多數細胞在移植后數小時內死亡。如 MüLLER-EHMSEN等[12]報道植入免疫缺陷小鼠心臟模型中的外源性骨髓間質干細胞在4 d內僅有不到0.4%存活,這些問題源于細胞增殖活性和多向分化潛能發生改變,極大地影響了治療效果,限制了其在組織再生、免疫調節方面的應用。
推薦閱讀:快速發表的醫學類普刊
為了在體外維持骨髓間充質干細胞的多向分化潛能和增殖活性,已經進行了細胞內和細胞外的干預方法。細胞內干預方法主要是通過基因改造來實現的,而細胞外干預方法主要是通過優化培養條件來實現的。然而,基因修飾的細胞很可能發生突變,降低了臨床應用的安全性。負壓吸引技術是一種物理刺激方式,目前有關體外負壓培養技術對間充質干細胞增殖影響的研究較少。研究表明,血管內皮生長因子可以促進間充質干細胞增殖[13]。實驗擬采用負壓體外培養骨髓間充質干細胞,探討細胞增殖情況以及血管內皮生長因子分泌水平,并初步分析細胞增殖指數與血管內皮生長因子分泌水平相關性。
1 材料和方法 Materials and methods
1.1 設計 細胞學實驗。
1.2 時間及地點 實驗于2017年11月至2018年11月在石河子大學轉化醫學動物實驗室完成。
1.3 材料
1.3.1 實驗動物 C57BL/6小鼠24只,SPF級,雌雄不限, 4-6周齡,購自新疆醫科大學實驗動物中心。
1.3.2 實驗試劑和儀器 低糖DMEM、胰蛋白酶(美國 Gibco 公 司 ) ; 胎 牛 血 清 ( 美 國 Hyclone 公 司 ) ; TRIzol Reagent(美國Invitrogen公司);cDNA合成試劑盒(美國 Thermo公司);熒光定量PCR試劑盒(美國Qiagen公司);血管內皮生長因子ELISA試劑盒(武漢伊萊瑞特生物科技有限公司);血管內皮生長因子受體抑制劑Axitinib(Selleck公司); EDU試劑盒(碧云天生物科技有限公司);PCR儀(美國 Thermo公司);血管內皮生長因子受體引物(上海生工公司)。
1.4 實驗方法
1.4.1 骨髓間充質干細胞原代培養與鑒定 參照課題組前期研究方法[14-15]。C57BL/6小鼠給予10%水合氯醛麻醉,頸椎脫臼法處死,乙醇消毒后置于超凈臺上,無菌條件下取出雙側股骨和脛骨,剔除兩端骨質。用無菌注射器抽取骨髓間充質干細胞培養基約5 mL(含體積分數為10%胎牛血清的LG-DMEM),立即更換1 mL無菌注射器針頭,反復沖洗骨髓腔,直至骨髓腔變為白色。將沖洗出的骨髓液吹打均勻后接種于60 mm無菌培養皿中,置于37 ℃、體積分數為5%CO2培養箱中培養48 h,PBS清洗2次,去除懸液中未貼壁細胞,加入新鮮配制的LG-DMEM培養基3 mL,隔日換液。待細胞生長至80%-90%融合時,棄去培養基,加入含0.25%EDTA的胰蛋白酶1 mL消化,顯微鏡下可見細胞回縮變圓、細胞間隙出現時,用含體積分數為10%胎牛血清的LG-DMEM培養基終止消化,用移液槍輕輕吹打,直至培養皿上大部分細胞脫落。收集細胞,1 000 r/min離心5 min,棄去上清液,用1 mL LG-DMEM完全培養基重懸細胞。將細胞懸液均勻接種至2個新培養皿中,按1∶2進行傳代培養,取傳3代細胞用于后續研究。
將第3代骨髓間充質干細胞接種于6孔板中,每孔加入 2 mL間質干細胞完全培養基,放入37 ℃,體積分數為 5%CO2孵箱中培養。待細胞達到80%-90%融合時,吸去舊培養液,每孔加入2 mL成骨誘導分化完全培養基,每3 d 換液1次,共換液7次。誘導21 d,鏡下觀察形成鈣結節,進行茜素紅染色,簡要步驟:小心輕緩倒去培養夜,加入 PBS輕緩漂洗,體積分數為10%中性甲醛固定30 min,加入約1 mL茜素紅染液覆蓋孔底,染色5 min左右,吸去染液,加入PBS輕緩漂洗,
1.4.2 細胞準備 將準備好的第3代骨髓間充質干細胞加入1 mL胰蛋白酶(含0.25%EDTA)消化,置于熒光倒置顯微鏡下觀察細胞形態收縮且少量開始漂浮,加入含體積分數為 10%胎牛血清的LG-DMEM培養基2 mL終止消化,使用1 mL 移液槍輕輕均勻吹打并收集于15 mL無菌離心管中, 1 000 r/min離心5 min收集細胞,吸棄上清,加入1 mL含體積分數為10%胎牛血清的DMEM培養基或含體積分數為 10%胎牛血清、內皮生長因子受體抑制劑的DMEM培養基重懸,吸取10 μL細胞懸液沖池細胞計數板,顯微鏡下行細胞計數,以3×105 /孔接種于6孔細胞培養皿中,震蕩混勻后,補充培養基至2 mL,標記并放入37 ℃、體積分數為5%CO2 培養箱中培養12 h備用;以3×103 /孔接種于96孔細胞培養皿中,震蕩混勻后,補充培養基至100 μL,標記并放入37 ℃、體積分數為5%CO2培養箱中培養12 h備用。將20個6孔板和 96孔板分別隨機分成對照組、-6.65 kPa組、-13.3 kPa組、 -26.6 kPa組,每組均有5個6孔板和5個96孔板。
1.4.3 細胞負壓培養 自制負壓吸引裝置:由一個吸痰機和一個負壓可調節吸引器及一個密閉的容器盒組成。各實驗組進行間歇性負壓培養,其中低負壓組預處理負壓壓力為-6.65 kPa、中負壓組預處理負壓壓力為-13.3 kPa、高負壓組預處理負壓壓力為-26.6 kPa,對照組為放置在培養箱中普通培養。在上述可調劑負壓裝置的培養箱中培養12, 24,36,48,60 h,負壓時間為2 h/次,每12 h 1次。
1.4.4 CCK-8細胞增殖實驗 在96孔板中接種細胞懸液 (100 mL/孔),放在37 ℃、體積分數為5%CO2培養箱進行間歇性負壓培養,向每孔加入10 mL的CCK-8溶液(注意不要在孔中生成氣泡,它們會影響吸光度值讀數),在培養箱內孵育3 h,用酶標儀測定450 nm處的吸光度值。
1.4.5 RT-PCR 檢測骨髓間充質干細胞中血管內皮生長因子受體mRNA表達 上述各組細胞負壓培養結束后 12 h,Trizol提取細胞總RNA,采用Nanodrop 2000(Thermo Fisher公司,美國)測量吸光度A260/A280,檢測RNA樣本濃度和純度,取200 ng總RNA反轉錄合成cDNA,加入PCR 儀中擴增(95 ℃預變性2 min,95 ℃變性5 s,55 ℃退火 30 s,60 ℃延伸10 s,共40個循環)。以β-actin作為內參,結果采用實時熒光定量PCR分析程序分析Ct值,采用2 -ΔΔCt 法計算目的基因mRNA相對表達量。引物序列:β-actin上游引物:5'-TTC CTT CTT GGG TAT GGA AT-3',下游引物:5'-GAG CAA TGA TCT TGA TCT TC-3';血管內皮生長因子受體上游引物:5'-ATC TTC AAG CCG TCC TGT GTG-3',下游引物:5'-AGG TTT GAT CCG CAT GAT CTG-3'。
1.4.6 各組細胞培養上清液的提取 將準備好的第3代骨髓間充質干細胞以3×105 /孔接種于6孔細胞培養皿中,震蕩混勻后,補充培養基至2 mL,標記并放入37 ℃、體積分數為5%CO2培養箱中培養12 h,每孔添加2 mL不含血清不含生長因子的DMEM培養液,各組給予對應的負壓條件,負壓干預結束后12 h,收集上清,以3 000 r/min離心 10 min,得到的上清液即為骨髓間充質干細胞培養上清液,離心后用于下一步ELISA檢測,簡要步驟:將待測樣品與血管內皮生長因子標準品加入包被有血管內皮生長因子抗體的96孔板中,37 ℃孵育1 h;加入100 μL檢測溶液A, 37 ℃孵育1 h;加入100 μL檢測溶液B,37 ℃孵育1 h;然后加入底物溶液90 μL,37 ℃避光顯色15-20 min。當標準品孔呈現明顯梯度藍色時,加入終止液50 μL終止反應。酶標儀450 nm波長處檢測各孔吸光度值,繪制標準曲線,通過標準曲線方程計算待測樣本血管內皮生長因子水
1.4.7 EDU標記及固定、洗滌和通透 將第3代骨髓間充質干細胞以3×105 /孔接種于6孔細胞培養皿中,負壓干預結束(-26.6 kPa干預24 h)后12 h后加入EDU繼續孵育2 h。 EDU標記細胞完成后,去除培養液,加入1 mL固定液(40 g/L 多聚甲醛),室溫固定15 min,然后每孔用1 mL洗滌液洗滌細胞3次,每次3-5 min;去除洗滌液,每孔用1 mL通透液(含 0.3% Triton X-100的PBS)室溫孵育10-15 min;去除通透液,每孔用1 mL洗滌液洗滌細胞一兩次,每次3-5 min;每孔加入0.5 mL Click反應液,輕輕搖晃培養板以確保反應混合物可以均勻覆蓋樣品,室溫避光孵育30 min;吸除Click 反應液,用洗滌液洗滌3次,每次3-5 min;吸除洗滌液后,每孔加入1×Hoechst 33342溶液1 mL,室溫避光孵育 10 min;吸除1×Hoechst 33342溶液,用洗滌液洗滌3次,每次3-5 min,隨后即可進行熒光檢測。Hoechst33342為藍色熒光,最大激發波長為346 nm,最大發射波長為460 nm。 1.4.8 克隆形成實驗 將第3代骨髓間充質干細胞以500 個/孔接種6孔培養板,每組設3個復孔,培養孔內為含體積分數為10%胎牛血清的完全培養基;培養12 h待細胞貼壁后,進行下列處理。將6孔板內培養基均棄掉,然后向6孔板第1孔加入2 mL含體積分數為10%胎牛血清的DMEM培養基,第2孔加入2 mL含體積分數為10%胎牛血清的 DMEM培養基,第3孔加入2 mL含終濃度為50 μmol/L Axitinib、體積分數為10%胎牛血清的DMEM培養基,加樣完畢后,完全混勻,并分組標記為對照組、負壓組、血管內皮生長因子受體抑制劑組,每組3個復孔。
上述6孔板在37 ℃、體積分數為5%CO2培養箱中連續培養48 h,吸棄原培養基,加入2 mL含體積分數為10%胎牛血清的DMEM培養基,在37 ℃、體積分數為5%CO2培養箱中給予-26.6 kPa干預培養24 h,對照組正常培養 24 h。每隔3 d進行換液并觀察細胞狀態,培養7 d后棄掉培養基,PBS洗滌細胞1次,每孔加入1 mL 40 g/L多聚甲醛,4 ℃冰箱固定60 min,PBS洗滌細胞1次,每孔加入潔凈、無雜質結晶紫染液1 mL,染細胞2 min,加入ddH2O 洗滌細胞數次,晾干,數碼相機拍照,計數克隆。
1.5 主要觀察指標 ①CCK-8試劑盒檢測不同負壓條件干預后各組骨髓間充質干細胞的增殖情況;②RT-PCR檢測不同負壓條件干預后各組骨髓間充質干細胞中血管內皮生長因子受體mRNA表達;③ELISA分析不同負壓條件干預后各組骨髓間充質干細胞培養上清液中血管內皮生長因子水平;④選擇一個最佳負壓條件和時間(-26.6 kPa,24 h) 用血管內皮生長因子受體抑制劑Axitinib阻斷后,CCK-8試劑盒檢測骨髓間充質干細胞增殖情況、EDU試劑盒檢測 EDU細胞陽性率、結晶紫染色觀察細胞集落形成單位。 1.6 統計學分析 使用SPSS 19.0統計軟件進行分析。數據以x _ ±s表示,組間比較采用重復測量方差分析,組內比較采用多樣本方差分析,P < 0.05為差異有顯著性意義。
2 結果 Results
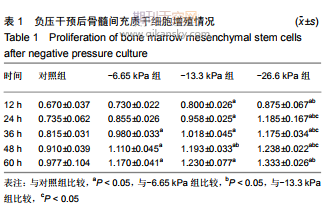
2.1 骨髓間充質干細胞的分離、培養和鑒定結果 原代培養48 h后細胞逐漸貼壁,其他類型的各種雜細胞通過頻繁換液逐漸除去,此時貼壁細胞大多呈梭形、多角形,單核細胞狀,細胞形態不一,或者為單個或多個細胞的克隆,細胞增殖迅速;培養3-5 d,細胞90%以上融合,融合細胞呈長梭形,細胞集落呈魚群狀生長。傳代后4 h可見細胞貼壁呈不規則形并伸出觸角;24 h后細胞全部貼壁,可見大部分細胞變為長梭形,具有方向性,部分細胞變為不規則形,雜細胞較少。成骨誘導21 d后茜素紅染色可見鈣結節紅染,見圖1。 2.2 不同負壓條件干預后各組骨髓間充質干細胞的增殖情況 各組細胞給予負壓干預后形態均一,生長旺盛,隨負壓培養時間延長大部分細胞變成不規則的多角形,細胞細長。隨著負壓壓力梯度升高,鏡下觀察到細胞生長旺盛、密集,并且胞體豐滿;與對照組相比,細胞增殖明顯增快,細胞集落增大,細胞間連接緊湊。與對照組相比,低負壓條件(-6.65 kPa)、中負壓條件(-13.3 kPa)、高負壓條件 (-26.6 kPa)對骨髓間充質干細胞增殖均具有促進作用(P < 0.05),見表1和圖2。
2.3 不同負壓條件干預后各組骨髓間充質干細胞培養上清液中血管內皮生長因子水平 負壓干預培養后,-6.65 kPa 組、-13.3 kPa組、-26.6 kPa組血管內皮生長因子分泌水平在5個時間點均高于對照組,且隨著負壓培養時間延長呈逐漸上升的趨勢。在負壓培養12 h時,-13.3 kPa組和 -26.6 kPa組血管內皮生長因子分泌量均高于-6.65 kPa組,然而在負壓培養24 h時,-13.3 kPa組和-26.6 kPa組血管內皮生長因子分泌量均低于-6.65 kPa組,且在12 h和24 h時, -13.3 kPa組、-26.6 kPa組血管內皮生長因子分泌量差異無顯著性意義。負壓干預36 h和48 h時,-26.6 kPa組血管內皮生長因子分泌量高于 -6.65 kPa組和-13.3 kPa組(P < 0.05),然而-6.65 kPa組與-13.3 kPa組比較差異無顯著性意義(P > 0.05)。負壓干預60 h時,-13.3 kPa組、-26.6 kPa 組血管內皮生長因子分泌量均低于-6.65 kPa組(P < 0.05), -26.6 kPa組血管內皮生長因子分泌量顯著高于-13.3 kPa 組(P < 0.05),見圖3A。
2.4 不同負壓條件干預后各組骨髓間充質干細胞中血管內皮生長因子受體mRNA表達 負壓干預12 h時,-26.6 kPa 組血管內皮生長因子受體mRNA表達水平高于-6.65 kPa 組、-13.3 kPa組(P < 0.05),-6.65 kPa組、-13.3 kPa組和對照組之間比較差異無顯著性意義(P > 0.05)。負壓干預 24 h時,-13.3 kPa組、-26.6 kPa組血管內皮生長因子受體 mRNA表達水平均高于-6.65 kPa組(P < 0.05),-26.6 kPa組血 管 內皮 生 長因 子 受體 mRNA 表達 水 平顯 著高 于 -13.3 kPa組(P < 0.05)。負壓干預36 h時,-26.6 kPa組血管內皮生長因子受體mRNA表達水平顯著高于-6.65 kPa 組、-13.3 kPa組和對照組(P < 0.05),對照組和-6.65 kPa 組之間比較差異無顯著性意義(P > 0.05)。負壓干預48 h時, -13.3 kPa組和-26.6 kPa組血管內皮生長因子受體mRNA 表達水平高于-6.65 kPa組和對照組(P < 0.05),-13.3 kPa 組和-26.6 kPa組之間比較差異無顯著性意義(P > 0.05)。負壓干預60 h時,-13.3 kPa組血管內皮生長因子受體mRNA 表達水平高于-6.65 kPa組和和-26.6 kPa組,-26.6 kPa組和-6.65 kPa組比較差異無顯著性意義(P > 0.05),見圖3B。
2.5 骨髓間充質干細胞增殖吸光度值與血管內皮生長因子分泌水平線性關系 根據線性關系分析,負壓干預后骨髓間充質干細胞增殖指標吸光度值與血管內皮生長因子分泌水平呈正相關,相關系數為 0.902,P < 0.05,見圖 4。
2.6 骨髓間充質干細胞在負壓和血管內皮生長因子受體抑制劑 Axitinib 干預后細胞增殖、克隆形成以及 EDU 標記情況 -26.6 kPa 條件下培養 24 h 后,血管內皮生長因子受體抑制劑組吸光度值、EDU 細胞陽性率及集落形成單位個數明顯低于負壓組(P < 0.05);與對照組比較,血管內皮生長因子受體抑制劑組吸光度值、EDU 細胞陽性率及集落形成單位個數差異無顯著性意義(P > 0.05),見圖 5,6。
3 討論 Discussion
負壓創面治療封閉吸引的引流方式,由德國ULM大學創傷外科醫院FLEISCHMANN博士在1993年首先報道,1995 年美國食品和藥物管理局(FDA)批準其上市,北美及歐洲將其正式應用于臨床[16]。美國ARGENTA等[17]運用相同的原理發明了真空輔助閉合裝置治療慢性難愈合創面,之后負壓吸引技術被廣泛用于臨床,其有效性得到了臨床醫務工作者的認同,目前對負壓吸引技術促進創面愈合的機制主要有幾個方面:①負壓吸引作用于細胞膜,使之擴張、扭曲,細胞自認為就是外界環境刺激,傳導損傷的信號給細胞核,通過信息傳遞,引起細胞分泌多種生長因子,包括表皮生長因子、血管內皮生長因子、轉化生長因子β1等從而促進細胞增殖和刺激周圍組織產生更多新生血管[18-20];②負壓吸引幫助建立創面體液平衡,提供一個濕潤的環境及清除壞死組織;③減少創面細菌的數量,抑制細菌生長[21];增加創面的血流,促進白細胞和成纖維細胞進入創面,其中白細胞能抵抗感染產生生長因子,而成纖維細胞能產生膠原,用來填平和修復傷口[22]。
最近,許多學者開始把負壓創面治療促進創面愈合機制的研究逐漸深入至分子水平,例如通過創面負壓吸引技術產生的機械牽拉作用可以誘導創面的多種細胞增殖、分化以及分泌多種細胞生長因子[23-24]。有研究表明負壓創面治療可增加輕、中度缺血性足部潰瘍患者循環內皮祖細胞的數量,這可能與其上調全身及局部血管內皮生長因子及基質細胞衍生因子1α水平有關[25]。血管內皮生長因子是血管內皮細胞特異性的肝素結合生長因子,可在體內誘導血管新生。血管內皮生長因子家族成員包括血管內皮生長因子A,B,C,D等,其由內皮細胞、角質形成細胞、成纖維細胞、平滑肌細胞、
間充質干細胞、嗜中性粒細胞以及巨噬細胞等細胞分泌。血管內皮生長因子在體外與間充質干細胞表面受體結合可以誘導其向內皮細胞分化、增殖和遷移[26-27],促進創面愈合[28]。基于上述研究,該實驗觀察負壓對于骨髓間充質干細胞增殖能力和分泌血管內皮生長因子水平的影響,并初步探討負壓條件下血管內皮生長因子是否參與骨髓間充質干細胞增殖,為今后負壓聯合干細胞臨床治療提供一定的實驗理論依據。
實驗探討低負壓(-6.65 kPa)、中負壓(-13.3 kPa)、高負壓(-26.6 kPa)3個不同負壓條件(12 h 1次,2 h/次)下對骨髓間充質干細胞增殖的影響。結果顯示,隨著負壓增高和培養時間的延長,骨髓間充質干細胞的增殖能力明顯增強。研究表明,-16.625 kPa持續性負壓吸引能促進骨髓間充質干細胞增殖,并誘導其向成骨表型分化[29]。還有研究報道 -39.9 kPa培養環境可以促進骨髓間充質干細胞增殖,然而 -79.8 kPa培養環境可以抑制骨髓間充質干細胞增殖[30]。 YANG等[31]研究表明負壓吸引體外細胞培養技術抑制骨髓間充質干細胞增殖。上述結果與此研究結果存在差異,可能與體外負壓裝置、培養時間和設定的培養條件有關。研究表明,相對于持續性負壓培養,間斷性負壓培養可以促進骨髓間充質干細胞增殖,其機制可能是因為骨髓間充質干細胞長期處于缺氧狀態對細胞存在一定損傷。此研究發現,負壓培養狀態下骨髓間充質干細胞上清中血管內皮生長因子水平也隨著負壓增加和培養時間的延長逐漸增加。負壓體外培養可以促進骨髓間充質干細胞分泌血管內皮生長因子誘導分化成骨[32]。研究發現,特定負壓條件可以上調骨髓間充質干細胞自分泌血管內皮生長因子水平,促進其向內皮細胞分化[32]。上述負壓促進骨髓間充質干細胞分泌血管內皮生長因子水平和此研究結果一致。根據線性相關分析各個時間點細胞增殖檢測指標吸光度值和血管內皮生長因子表達水平呈正相關。為了進一步探究血管內皮生長因子與骨髓間充質干細胞增殖的關系,用血管內皮生長因子受體特異性抑制劑聯合最佳負壓模式共同干預骨髓間充質干細胞。結果顯示,血管內皮生長因子受體抑制劑組細胞增殖吸光度值和EDU陽性細胞率明顯低于負壓組。在適度的負壓環境下細胞增殖明顯增強,由于作者所在實驗室的負壓裝置最大可調控負壓為 -26.6 kPa,故實驗分組設定最大負壓強度為-26.6 kPa。
綜上所述,隨著負壓強度增大,骨髓間充質干細胞可能通過上調血管內皮生長因子分泌促進其增殖。關于負壓如何上調骨髓間充質干細胞分泌血管內皮生長因子水平,以及血管內皮生長因子如何介導骨髓間充質干細胞增殖的具體機制有待研究。
SCISSCIAHCI