發布時間:2020-02-24所屬分類:醫學論文瀏覽:1次
摘 要: 摘要背景:研究表明雙硫侖本身具有抗腫瘤活性,可聯合銅(Cu)離子在體內外水平對多種腫瘤發揮抑癌作用,但關于雙硫侖對骨肉瘤細胞增殖和凋亡作用的影響尚未闡明。 目的:探討雙硫侖-Cu 在體內外水平對骨肉瘤增殖與凋亡能力的影響以及可能的作用機制。 方法:
摘要背景:研究表明雙硫侖本身具有抗腫瘤活性,可聯合銅(Cu)離子在體內外水平對多種腫瘤發揮抑癌作用,但關于雙硫侖對骨肉瘤細胞增殖和凋亡作用的影響尚未闡明。
目的:探討雙硫侖-Cu 在體內外水平對骨肉瘤增殖與凋亡能力的影響以及可能的作用機制。
方法:實驗方案經山西醫科大學動物實驗倫理委員會批準(批準號為 2017LL077)。①體外實驗:配置雙硫侖在進入人體后的轉換物二乙基二硫代氨基甲酸鈉(diethyldithiocarbamate,DDTC)和 Cu 離子的復合物 DDTC-Cu(0.5,1,2,3 和 5 μmol/L),設置 DDTC 單藥(5 μmol/L)、Cu 單藥(5 μmol/L)和空白對照組。藥物處理人骨肉瘤細胞 Saos-2 細胞和 MG-63 細胞,CCK8 法檢測不同濃度 DDTC-Cu 對 Saos-2 細胞和 MG-63 細胞的增殖抑制作用;采用 AnnexinV-FITC/PI 雙染法檢測 DDTC-Cu 對 Saos-2 細胞凋亡水平變化;②體內實驗:取 4 周齡 BALB/c-nu/nu 雌性裸鼠共 10 只,隨機分為 DDTC-Cu 組和對照組。采用異位移植方法,在裸鼠右側背部皮下注射 Saos-2 細胞和 Matrigel 混懸液(1∶1 混合),注射量 400 μL/只;接種 2 周后,對照組裸鼠腹腔注射地塞米松(0.5 mg/kg,隔日 1 次),DDTC-Cu 組裸鼠腹腔注射地塞米松(0.5 mg/kg,隔日 1 次) 和 DDTC-Cu 復合物(10 nmol/g,隔日 1 次);觀察兩組荷瘤小鼠移植瘤生長情況,繪制瘤體生長曲線。接種 5 周后麻醉下處死動物,完整取出瘤體,免疫組織化學檢測瘤體石蠟切片組織中 ki67 蛋白的表達水平,Western blot 檢測瘤體組織中細胞增殖和凋亡蛋白的表達及 JNK 通路蛋白表達的變化。結果與結論:①體外實驗結果:DDTC-Cu 組對骨肉瘤細胞的增殖抑制作用明顯高于其他 3 組;CCK-8 實驗結果顯示DDTC-Cu對骨肉瘤細胞增殖抑制呈劑量依賴性,兩株細胞的24 h藥物半抑制濃度分別為0.337 μmol/L 和 0.487 μmol/L;流式細胞學檢測結果顯示 DDTC-Cu 可呈劑量依賴性促進 Saos-2 細胞的凋亡;②體內實驗結果:DDTC-Cu 組裸鼠移植瘤的體積和質量均小于對照組;免疫組織化學結果顯示,DDTC-Cu 組的瘤體中 ki-67 蛋白表達水平較對照組降低;Western blot 檢測結果顯示,DDTC-Cu 組瘤體蛋白中 p-JNK 和 c-jun 的表達水平均上調。結果提示,雙硫侖聯合 Cu 離子在體內外水平抑制人骨肉瘤細胞增殖并促進骨肉瘤細胞凋亡,其作用機制可能與 JNK 通路活化有關。
關鍵詞:雙硫侖;銅;骨肉瘤;增殖;凋亡;JNK 通路
0 引言
Introduction 骨肉瘤是最常見的原發性惡性骨腫瘤,好發于青少年,其惡性程度高、侵襲性強、復發和轉移率高。近年來,隨著輔助化療及外科應用水平的提高,骨肉瘤的治療效果已有明顯改善,但其術后局部復發率高達10%-20%[1- 2],嚴重的是有近一半的骨肉瘤患者出現轉移,主要發生肺轉移,且約有80%發生轉移的患者在5年內死亡[3]。借助分子生物學、免疫學等有利工具,發掘新的生物標志物和治療靶點對骨肉瘤的有效診斷和治療具有重要臨床意義。近年來對 “老藥新用”的研究已成為國際抗腫瘤研究的熱點之一。雙硫侖又名戒酒硫,于1948年由哥本哈根的JACOBSEN 等發現,是一種能夠抑制醇乙醛脫氫酶的二硫代氨基甲酸鹽藥物,可致酒精代謝產物乙醛在體內蓄積并產生氧化反應,使患者對飲酒產生負面反射,從而達到戒酒治療的目的。LEE等[4]發現,雙硫侖可通過聯合放射治療,增強非典型畸胎橫紋肌樣瘤干細胞凋亡和自噬,抑制腫瘤生長。雙硫侖-Cu可通過影響腫瘤細胞蛋白酶活性進而抑制胰腺癌細胞的增殖[5]。但雙硫侖在骨肉瘤中是否發揮抑癌作用,目前尚不明確。研究通過合成雙硫侖在進入人體后的轉換物二乙基二硫代氨基甲酸鈉(diethyldithiocarbamate, DDTC)與Cu的復合物,使研究方法更接近臨床患者體內水平層面,從體外和體內實驗分別驗證雙硫侖對骨肉瘤增殖和凋亡的作用,為骨肉瘤將來臨床分子靶向治療和藥物研發提供科學理論依據。
1 材料和方法 Materials and methods
1.1 設計 體外水平進行分子生物學實驗,動物模型體內驗證。
1.2 時間及地點 實驗于2018年2月至12月在山西醫科大學第二醫院骨與關節損傷山西省重點實驗室完成。 1.3 材料 1.3.1 人骨肉瘤細胞細胞系 Saos-2和MG-63購自美國模式培養物集存庫(American Type Culture Collection, ATCC)。
1.3.2 實驗用主要試劑 RPMI 1640培養基、胎牛血清 (FBS) 和 胰 蛋 白 酶 消 化 液 購 自 Gibco 公司。 DDTC (C5H10NS2·Na·3H2O)、二氯化銅(CuCl2·2H2O)和亞硫酸鈉 (Na2SO3)購自Sigma-Aldrich公司。CCK8試劑盒購自博士德。Annexin V-FITC/PI細胞凋亡檢測試劑盒購自凱基生物。錐蟲藍染色細胞存活率檢測試劑盒購自博士德公司。Matrigel膠、6孔板和96孔板購自美國Corning公司。PCNA、 Cleaved Caspase-3、PARP、GAPDH和β-actin抗體購自 Cell Signaling Technology公司,ki-67、p-JNK和p-c-jun 抗體購自Santa Cruz Biotechnology公司。
1.3.3 實驗動物 4周齡BALB/c-nu/nu雌性裸鼠購自北京維通利華實驗動物技術有限公司,體質量15-20 g,生產許可證號:SCXK(京)2014-0006,使用許可證號:SYXK(晉) 2015-0001。
1.4 實驗方法
1.4.1 細胞培養 取液氮中凍存的細胞復蘇,加入含體積分數10%FBS、1%青鏈霉素的RPMI 1640完全培養液,置于37 ℃、體積分數5%CO2和9%濕度培養箱中培養。取處于對數生長期細胞,棄瓶內培養液,用PBS(0.01 mol/L) 清洗2遍,加入含乙二胺四乙酸(EDTA)胰蛋白消化酶 (0.25%)1 mL,靜置2 min,鏡下觀察細胞逐漸變圓或有細胞脫落時加入完全培養液終止消化,吹打管輕柔吹打細胞懸液后傳代。
1.4.2 化學藥物合成 首先將DDTC、CuCl2和Na2SO3溶于無菌水,分別制備成200 mmol/L濃度的溶液。再取上述 50 μL DDTC溶液、25 μL Na2SO3溶液和50 μL CuCl2溶液加至9 mL無菌水中,輕混勻。最后加入無菌水至混勻液,使總量達到10 mL,輕混勻,制備成終濃度為1 mmol/L的 DDTC-Cu復合物,4 ℃保存。實驗中用于細胞實驗及動物注射的DDTC和Cu的濃度均為1 mmol/L[5]。
1.4.3 細胞增殖-毒性檢測 半抑制濃度(IC50)數值由劑量反應曲線得出。抑制率按公式抑制率(%)=[(對照孔-實驗孔)/(對照孔-空白孔)]×100%計算。根據兩株細胞的IC50結果,選取抑制效率高的細胞進行后續動物實驗。采用CCK-8 法,收集對數期細胞,調整細胞懸液濃度,96孔板每孔加入 100 μL,使待測細胞調濃度至(1×103 -1×104 )/孔,常規培養 24 h,設置對照組,DDTC-Cu組(0.5,1,2,3和5 μmol/L)、 DDTC組(5 μmol/L)和Cu組(5 μmol/L),對照組僅加入完全培養液,空白孔內為不含細胞和待測物質的培養基用于去除實驗背景干擾。每孔加入10 μL CCK-8溶液,培養箱內孵育2 h,用酶標儀檢測450 nm處吸光度值[D(450)]。
1.4.4 流式檢測細胞凋亡 采用AnnexinV-FITC/PI雙染法,消化重懸離心收集細胞,用PBS洗滌細胞2次,收集1×105細胞,加入500 μL的Binding Buffer懸浮細胞,再分別加入5 μL的AnnexinV-FITC和Propidium Iodide試劑混勻。室溫避光反應10 min后進行流式細胞儀檢測。
1.4.5 錐蟲藍染色檢測活細胞生存率 采用錐蟲藍染色試劑盒,消化離心收集細胞,用2 mL細胞稀釋液重懸細胞。各取100 μL的細胞重懸液和錐蟲藍(2X)染液,加入EP管中輕混勻,3 min內用血細胞計數板計數活細胞和死細胞。活細胞率(%)=[(細胞總數-死細胞數)/細胞總數]×100%計算。
1.4.6 動物實驗 4-6周齡雌性BALB/c裸鼠購自北京維通利華公司,體質量15-20 g,共10只,隨機分為DDTC-Cu 組和對照組,每組5只。麻醉裸鼠后,在右側背部皮下用提前預冷的微量進樣器和29G針頭,注射Saos-2細胞和 Matrigel混懸液(1∶1混合),注射量為每只400 μL[6]。接種 2周后,對照組裸鼠腹腔注射地塞米松(0.5 mg/kg,隔日1 次),DDTC-Cu組裸鼠腹腔注射地塞米松(0.5 mg/kg,隔日 1次)和DDTC-Cu復合物(10 nmol/g,隔日1次)。每3 d測量瘤體的長度(L)、寬度(W),體積大小按公式:V=1/2LW2進行計算。接種5周后,麻醉后完整取出瘤體,稱質量拍照后固定在多聚甲醛溶液中24 h,石蠟包埋切片,常溫保存。
1.4.7 免疫組織化學檢測瘤體組織中ki-67的表達 動物瘤樣本常規脫水石蠟包埋,病理切片,組織厚度5 μm。切片常規脫蠟至水,抗原采用熱修復。一抗(ki-67抗體)4 ℃ 孵育過夜,陰性對照組為加入PBS代替一抗。自然晾干滴后加二抗室溫孵育15 min。DAB顯色,最后脫水透明,封固鏡檢。采用全自動玻片掃描儀(3DHISTECH)檢測,掃描控制軟件計數陽性細胞數。
1.4.8 Western Blot檢測瘤體組織中增殖細胞核抗原 PCNA、凋亡蛋白Cleaved Caspase-3、Cleaved PARP及通路蛋白anti-p-JNK和p-c-jun的表達 取瘤體組織蛋白提取液,BCA法檢測蛋白濃度,-80 ℃保存備用。蛋白混勻 4×Loading Buffer后100 ℃煮10 min,按每上樣孔50 μg加入至10%分離膠中,電泳轉膜,5%脫脂奶粉TBST封閉,一抗(anti-PCNA:cat. 2586,1∶2 000稀釋;anti-Cleaved Caspase-3:cat. 9664,1∶1 000稀釋;anti-Cleaved PARP:cat. 5625,1∶800稀釋;anti-GAPDH:cat. 5174, 1∶800稀釋;anti-β-actin:cat. 4970,1∶1 000稀釋; anti-ki-67 : sc-23900 , 1 ∶ 500 稀 釋 ; anti-p-JNK : sc-293136,1∶500稀釋;anti-p-c-jun:sc-53182,1∶200 稀釋)4 ℃過夜孵育。TBST洗膜3次后孵育二抗,ECL發光檢測。實驗重復3次,采用Image J軟件測量灰度值。
1.5 主要觀察指標 ①體外實驗檢測DDTC-Cu對骨肉瘤細胞增殖的抑制作用和促進骨肉瘤細胞凋亡的作用;②體內實驗檢測DDTC-Cu對瘤體生長的影響,并檢測瘤體組織中DDTC-Cu對增殖蛋白PCNA、ki-67、凋亡蛋白Cleaved Caspase-3、Cleaved PARP和信號通路蛋白anti-p-JNK和 p-c-jun的影響。
1.6 統計學分析 使用SPSS 20.0統計軟件分析,瘤體質量和體積數據呈正態分布,以x _ ±s表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析,兩兩間比較采用 SNK-q檢驗;應用GraphPad Prism 5軟件繪制劑量反應曲線和瘤體生長曲線圖,檢驗水準:α=0.05。
相關知識推薦:抗腫瘤的論文可以投哪些雜志
2 結果 Results
2.1 體外實驗結果
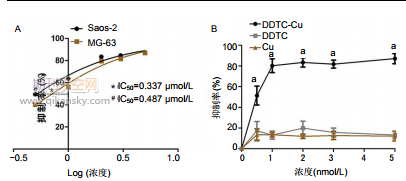
2.1.1 IC50擬合曲線結果 Saos-2細胞和MG-63細胞的 24 h的IC50分別為0.337 μmol/L和0.487 μmol/L。選取藥物抑制率更高的Saos-2細胞進行后續動物實驗。采用CCK-8 法 檢 測 DDTC-Cu 對 細 胞 增 殖 抑 制 的 劑 量 依 賴 性 。 DDTC-Cu(5 μmol/L)對骨肉瘤細胞的抑制作用較對照組、 DDTC組和Cu組均明顯增強,見圖1。
2.1.2 AnnexinV-FITC/PI雙染結果 DDTC-Cu誘導24 h 后,流式細胞儀檢測結果顯示,在MG-63細胞中,DDTC-Cu 在濃度為0,1,3和5 μmol/L的凋亡率分別為(7.037± 0.502)%,(9.013±0.428)%,(13.180±0.654)%和(14.420± 0.197)%。在Saos-2細胞中,DDTC-Cu在濃度為0,1,3 和5 μmol/L 的凋亡率分別為(7.433±0.493)%,(10.70± 0.30)% , (12.700±0.361)% 和 (15.10±0.10)% 。 并 且 , DDTC-Cu誘導24 h后細胞出現胞體變圓、縮小和脫落。錐蟲藍染色顯示隨DDTC-Cu濃度升高,活細胞越少,見圖2。
2.2 體內實驗結果
2.2.1 腫瘤體積及質量比較 裸鼠接種細胞2周后,隨機分為DDTC-Cu組和對照組。接種Saos-2細胞5周后,對照組腫瘤體積較DDTC-Cu組明顯增大[(2 638.0±767.2)vs. (507.8±93.6) mm3 ]。取出瘤體稱質量,結果顯示對照組瘤體質量明顯重于DDTC-Cu組(2.950±0.843) vs. (1.413± 0.295) mm3,見圖3。
2.2.2 免疫組織化學檢測結果 裸鼠荷瘤組織中ki-67的表達差異,結果顯示DDTC-Cu組瘤體內ki-67陽性蛋白表達量明顯低于對照組,見圖4。
2.2.3 Western blot檢測裸鼠瘤體組織中增殖蛋白、凋亡蛋白和通路蛋白的表達 結果顯示DDTC-Cu組的PCNA 蛋白表達低于對照組,而凋亡蛋白Cleaved Caspase-3、 Cleaved PARP和通路蛋白anti-p-JNK和p-c-jun的表達均高于對照組,見圖5。
3 討論 Discussion
骨肉瘤目前標準的治療方法包括手術切除和全身化療,然而這些治療方法的療效有限,特別是對于轉移或復發性骨肉瘤患者,預后較差[7]。實際上,有耐藥性或轉移性骨肉瘤患者的5年生存率不足30%[8],并且現用的化療藥物靶向性差,可能會引起許多嚴重不良反應[9]。化療藥物的毒副作用和耐藥特性嚴重影響骨肉瘤療效的進一步提高,從安全評估較成熟且廉價藥物中開發能夠抗骨肉瘤活性的新用途,近年來已引起廣泛學者關注。
雙硫侖是一種廣泛用于治療慢性酒精上癮以及古柯堿的戒斷藥物,近年來,雙硫侖與Cu的螯合劑在抗腫瘤過程中發揮著重要作用,“老藥新用”開始得到學者重視。多項研究報道,雙硫侖可通過螯合Cu離子,對多種腫瘤細胞發揮抑制增殖且誘導凋亡的抑癌作用。Cu離子被證實可參與機體內的氧化還原反應,不僅可導致DNA的損傷,還可誘導蛋白質和脂質變性,導致細胞凋亡[10]。YANG等[11]發現,雙硫侖-Cu通過改變鼻咽癌CNE-2Z細胞的細胞形態和膜超微結構,影響癌細胞的遷移、黏附和凋亡能力進而影響腫瘤進程。體內外實驗證明雙硫侖-Cu可通過抑制ALDH2 的表達,逆轉癌細胞對微管抑制劑的耐藥性,使得化療藥物易產生耐藥性得以轉歸[12]。另外雙硫侖-Cu對非小細胞肺癌細胞具有顯著的細胞毒性和caspase依賴性凋亡,并能在細胞質中形成空泡,證實其促腫瘤細胞凋亡能力[13]。另有研究表明,雙硫侖可通過 ERK/NF-κB/Snail信號通路抑制由轉化生長因子β介導的上皮間充質轉化,進而發揮抑制乳腺癌的侵襲作用[14]。但雙硫侖在骨肉瘤中是否扮演抑癌角色,目前尚不明確。
雙硫侖是二硫代氨基甲酸鹽,水溶性極差。研究人員在進行實驗時,普遍將其溶于含硫有機化合物二甲基亞砜中,達到水溶效果[15-16]。但二甲基亞砜在高溫下有分解現象,遇氯能發生劇烈反應并且存在一定的毒性[17]。研究顯示雙硫侖在進入人體后會迅速轉化為體內代謝物DDTC, Cu可與DDTC結合形成較穩定的DDTC-Cu復合物[5],使得研究對象和方式更接近體內狀態水平。并有學者發現在 Wilson病中,不論在實驗組還是對照組,Cu的含量均不會大幅增加,證實體內注射的Cu仍受機體新陳代謝的調節[18-19]。故此次研究使用合成的DDTC-Cu復合物進行相關研究。此次研究首先通過體外實驗證實DDTC-Cu可呈劑量依賴性抑制骨肉瘤細胞增殖,并促進骨肉瘤細胞凋亡。進一步的體內實驗得到與體外實驗相同結果,DDTC-Cu可抑制荷瘤小鼠瘤體的生長。
目前雙硫侖的抗腫瘤機制與ROS-NFκB 信號通路活化有關 。研 究表 明雙 硫侖 -Cu的抗腫 瘤能 力可 能與 NF-kappaB、ROS及JNK通路有關[11,20]。KIM等[21]指出JNK 信號通路的持續活化在人類腫瘤細胞凋亡進程中發揮促凋亡作用。JNK信號通路是MAPKs信號轉導通路,在凋亡的啟動過程中扮演重要角色。另外,外源性腫瘤壞死因子α 可通過P-JNK/SAPK途徑導致人髓核細胞凋亡[22]。目前雙硫侖的抗腫瘤機制也與其可形成高效的蛋白酶體抑制劑有關。雙硫侖與Cu的螯合物則是十分高效的蛋白酶體抑制劑之一,可通過抑制腫瘤細胞蛋白酶的活性進而促進凋亡發生。研究表明,雙硫侖與Cu結合后可通過抑制結腸癌細胞中蛋白酶的活性促進細胞凋亡[23]。此次研究通過提取動物模型瘤體蛋白,結果發現DDTC-Cu可抑制增殖蛋白PCNA 的表達,促進凋亡蛋白Cleaved Caspase-3和Cleaved PARP、JNK信號通路蛋白及下游底物p-c-Jun的表達。另外免疫組織化學檢測瘤體中增殖蛋白ki-67的表達,結果同樣顯示DDTC-Cu組瘤體內ki-67陽性蛋白表達量明顯高于對照組。
綜上,雙硫侖可與Cu結合可在體外和體內水平抑制骨肉瘤細胞增殖,其機制可能是通過活化JNK信號通路促進骨肉瘤細胞凋亡。研究后續會優化雙硫侖給藥途徑,并進行臨床骨肉瘤樣本驗證及機制探索,為雙硫侖未來能在臨床骨肉瘤治療中“老藥新用”并闡明機制方面提供科學理論依據。
SCISSCIAHCI