發布時間:2020-02-24所屬分類:醫學論文瀏覽:1次
摘 要: 摘要背景:人尿源性干細胞是近年來新發現的成體干細胞,其來源不受限制,提取簡便,具備良好的增殖能力及多向分化潛能,近年來已應用于泌尿系疾病中的神經功能修復,如應激性尿失禁以及膀胱輸尿管返流等。目的:探索人尿源性干細胞向神經元樣細胞誘導分化能
摘要背景:人尿源性干細胞是近年來新發現的成體干細胞,其來源不受限制,提取簡便,具備良好的增殖能力及多向分化潛能,近年來已應用于泌尿系疾病中的神經功能修復,如應激性尿失禁以及膀胱輸尿管返流等。目的:探索人尿源性干細胞向神經元樣細胞誘導分化能力及對大鼠脊髓損傷的修復作用。方法:體外獲取人尿源性干細胞后利用流式細胞儀檢測其細胞表型,將人尿源性干細胞向神經元樣細胞誘導后進行免疫組織化學染色鑒定。采用Allen方法制作大鼠T9節段脊髓損傷模型,24只SD大鼠被隨機分為2組:脊髓損傷組和人尿源性干細胞組,每組12只。人尿源性干細胞組在脊髓損傷后第1天于損傷脊髓邊緣注入2μL細胞濃度為1.0×1011L-1人尿源性干細胞,脊髓損傷組注入等量含體積分數為10%胎牛血清的L-DMEM培養液,于造模后第1,10,20,30天進行BBB評分,第30天取各組損傷脊髓組織分別進行LuxolFastBlue染色、小膠質細胞/巨噬細胞染色和膠質纖維酸性蛋白染色,并計算損傷脊髓面積和膠質纖維酸性蛋白熒光強度。結果與結論:①人尿源性干細胞高表達CD29、CD90,而低表達CD45,并且在體外可向神經元樣細胞誘導分化;②造模后第1,10天兩組大鼠BBB評分差異無顯著性意義(P>0.05),第20,30天人尿源性干細胞組BBB評分明顯高于脊髓損傷組(P<0.05);③人尿源性干細胞組脊髓損傷面積明顯低于脊髓損傷組(P<0.05),膠質纖維酸性蛋白染色顯示人尿源性干細胞組熒光強度明顯低于脊髓損傷組(P<0.05);④結果表明,人尿源性干細胞能向神經元樣細胞分化,并對大鼠脊髓損傷具有修復作用。
關鍵詞:脊髓損傷;人尿源性干細胞;神經修復;BBB 評分;膠質纖維酸性蛋白;國家自然科學基金
0引言Introduction
脊髓損傷后神經細胞缺失及損傷局部微環境改變、氧化應激和炎癥介入,導致脊髓很難出現自發性的功能和結構恢復[1]。目前,國內外對于脊髓損傷的研究都極為重視,組織工程是研究脊髓損傷中最為重要的環節,在種子細胞選擇方面,已有神經干細胞、骨髓間充質干細胞、脂肪間充質干細胞以及嗅鞘細胞、許旺細胞等應用于動物脊髓損傷修復中,以上細胞對于動物脊髓損傷具有一定的修復作用,但目前還沒獲得滿意效果[2]。因此,需要尋求一種新的具有神經修復作用的種子細胞顯得十分必要。
人類尿液中存在多種細胞,大體可分為3類:終末分化細胞、具有增殖能力的不完全成熟細胞和未分化的前體細胞,后兩者具有貼壁作用,可利用貼壁法提取,不完全成熟細胞數量較少,約占0.1%,在傳代中數量逐漸減少,前體細胞具有較強的自我增殖能力和多向分化能力,即為人尿源性干細胞(humanurine-derivedstemcells,hUSCs)。人尿源性干細胞是近年來新發現的成體干細胞,可能是細胞治療或組織工程中一種具有應用前景的種子細胞,其來源不受限制,提取簡便。研究顯示,100mL尿液可提取3個人尿源性干細胞,經傳代培養2周可獲取1.0×104個細胞。人尿源性干細胞還具備良好的增殖能力及多向分化潛能,已逐漸引起學者的青睞,近年來已應用于泌尿系疾病,如應激性尿失禁以及膀胱輸尿管返流等[3-4]。已有研究報道,人尿源性干細胞聯合硫酸軟骨素酶ABC(chondroitinasesulfateABC,chABC)對大鼠脊髓損傷進行干預,已取得不錯的修復效果[5]。
該研究將人尿源性干細胞在體外向神經元樣細胞誘導分化,然后移植到脊髓損傷大鼠體內,觀察人尿源性干細胞對大鼠脊髓損傷的修復作用。
1材料和方法Materialsandmethods
1.1設計體外細胞學實驗聯合體內實驗。
1.2時間及地點實驗于2017年1月至2018年6月在武漢大學動物實驗中心完成。
1.3材料
1.3.1實驗動物SPF級SD大鼠24只,6-8周齡,雌雄各半,體質量250-270g,由湖南斯萊克景達實驗動物有限公司提供,動物合格證編號:SCXK(鄂)2013-0004;所有動物均符合武漢大學人民醫院倫理委員會對動物實驗的要求和規定,所有動物進入實驗前適應性喂養1周。
1.3.2實驗試劑、儀器Allen打擊器(武漢大學人民醫院實驗動物中心提供)。低糖DMEM、胎牛血清、PBS、甲苯胺藍染液、茜素紅染液(Sigma公司,美國);抗β微管蛋白(Anti-betaⅢTubulin,β-tubulin3)單克隆抗體、兔抗大鼠膠質纖維酸性蛋白(glialfibrillaryacidicprotein,GFAP)多克隆抗體(Abcam公司,美國);小鼠抗兔二抗(中杉金橋公司,中國);戊巴比妥鈉(百奧萊博公司,北京);熒光倒置顯微鏡(Olympus公司,日本);流式細胞儀(BectonDickinson公司,美國);DAB顯色試劑盒(SantaCruz公司,美國);ImageProPlus6.0軟件(MediaCybernetics公司,美國)。
1.4實驗方法
1.4.1人尿源性干細胞的分離培養及多向分化收集15-30歲健康男性尿液,供者及家屬均知情同意。
留取尿液前充分清洗尿道,無菌條件下收集中段尿液300mL,按照文獻[6]的方法,取100mL尿液加入5mL含8×105U青霉素、1×106U鏈霉素的雙抗,充分混勻后,以500×g離心15min后棄上清液,PSB混勻后再次以500×g離心15min,棄上清后用5mL含體積分數為10%胎牛血清的DMEM培養基重懸,置于培養箱中2h,提取原代人尿源性干細胞,利用0.25%胰蛋白酶消化傳代,將第3代人尿源性干細胞分別向成軟骨、成骨方向誘導并利用甲苯胺藍染色和茜素紅染色鑒定。根據文獻[7]的方法,將人尿源性干細胞向成神經方向誘導并利用β-tubulin3免疫組織化學染色鑒定。
1.4.2流式細胞儀檢測人尿源性干細胞表型取第3代人尿源性干細胞,消化、離心,制成細胞濃度為2.0×1012L-1的單細胞懸液轉移至流式管中,根據文獻[8]的方法,利用流式細胞儀對表面標記物CD29、CD90和CD45進行檢測。
1.4.3實驗分組及干預24只SD大鼠隨機分為2組:脊髓損傷組和人尿源性干細胞組,每組12只。大鼠通過腹腔注射質量分數為3%戊巴比妥鈉麻醉,咬除T8-10椎板,暴露T9段脊髓。采用Allen法將10g打擊錘固定于脊髓上方7cm高度(致傷量為70g/cm)。
脊髓損傷模型成功的標志:在Allen裝置撞擊脊髓的瞬間,動物身體抖動,雙下肢迅速發生回縮及彈動動作,尾巴翹起并迅速倒下,打擊局部脊髓表面迅速呈瘀紫色,術后雙下肢出現完全癱瘓說明造模成功。
造模后均進行單籠飼養,人工輔助排尿。人尿源性干細胞組在脊髓損傷后第1天于損傷脊髓邊緣注入2μL細胞濃度為1.0×1011L-1原代人尿源性干細胞,脊髓損傷組在脊髓損傷后第1天于損傷脊髓邊緣注入等量含體積分數為10%胎牛血清的L-DMEM培養液。
1.5主要觀察指標
1.5.1后肢運動功能評分觀察各組大鼠術后存活、切口愈合情況。造模后第1,10,20,30天采用BBB評分評價大鼠后肢運動功能。根據大鼠后肢各關節活動、后肢的步態和協調功能、運動時爪子的精細運動進行評分;總分為0分表示完全癱瘓,21分為完全正常活動。以左、右兩側肢體評分均值作為最終評分。
1.5.2組織學及免疫組織化學染色取術后30d各組脊髓組織約10mm,100g/L多聚甲醛固定48h,石蠟包埋,從損傷脊髓中心部位縱切面連續切片,片厚5μm。取部分切片行LuxolFastBlue和小膠質細胞/巨噬細胞染色,倒置相差顯微鏡下觀察脊髓組織和神經元細胞的形態學改變并計算損傷面積(mm2)。余切片行膠質纖維酸性蛋白免疫組織化學染色,熒光顯微鏡下觀察,每張切片隨機取3個視野,利用ImageProPlus6.0軟件檢測膠質纖維酸性蛋白熒光強度。
1.6統計學分析采用SPSS19.0(IBM公司,美國)統計軟件進行分析。數據以x_±s表示,組內各時間點間比較采用單因素方差分析,兩兩比較采用Posthoc分析;兩組間比較采用獨立樣本t檢驗,檢驗水準α=0.05。
相關知識推薦:國家級知網收錄的醫學期刊有哪些
2結果Results
2.1人尿源性干細胞的形態學觀察及鑒定結果原代人尿源性干細胞呈橢圓形、梭形或不規則形,增殖能力強,傳代后細胞分化成熟,胞質向周圍伸展,胞體呈長梭形,傳至第3代后出現均一細胞集落,并呈漩渦樣生長,見圖1A。人尿源性干細胞成軟骨誘導21d后甲苯胺藍染色可見胞質藍染,見圖1B;成骨誘導21d后茜素紅染色可見紅染的鈣化灶,見圖1C;向神經元樣細胞誘導96h后可見部分細胞胞質向四周放射,見圖1D;β-tubulin3染色可見綠染的抗微管蛋白,見圖1F。經流式細胞儀檢測結果顯示,第3代人尿源性干細胞高表達CD29、CD90,表達率為(98.34±0.57)%,(99.31±0.23)%,而低表達CD45,表達率為(1.88±0.16)%,見圖2。
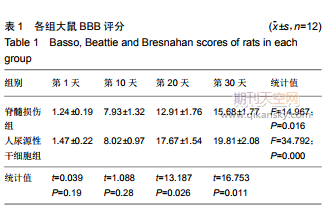
2.2各組大鼠后肢運動功能評分術后各組大鼠均存活,切開無紅腫等感染表現。術后第1,10,20,30天,兩組大鼠BBB評分逐漸增高,第1,10天兩組大鼠BBB評分差異無顯著性意義(P>0.05),第20,30天人尿源性干細胞組BBB評分明顯高于脊髓損傷組(P<0.05),見表1。
2.3組織學觀察結果LuxolFastBlue染色及小膠質細胞/巨噬細胞染色顯示,脊髓損傷組神經元細胞腫脹壞死,嚴重的脫髓鞘樣改變,并出現較多炎性細胞浸潤,脊髓中央出現空洞,缺損面積較大;人尿源性干細胞組神經元細胞腫脹,少量炎性細胞浸潤,脫髓樣改變明顯減少,脊髓中央空洞較小,缺損面積較小。半定量分析顯示,脊髓損傷組脊髓缺損面積為(6.71±0.96)mm2,人尿源性干細胞組脊髓缺損面積為(2.86±0.74)mm2,人尿源性干細胞組脊髓缺損面積顯著低于脊髓損傷組(P<0.05),見圖3。
2.4免疫組織化學染色觀察結果脊髓損傷組膠質纖維酸性蛋白主要集中于脊髓損傷區表達,其中損傷邊緣膠質界膜邊界清晰,損傷區內部空洞形成;而人尿源性干細胞組脊髓損傷區可見少量膠質纖維酸性蛋白陽性表達,損傷區內部空洞較小。脊髓損傷組熒光強度值為14.67±1.09,人尿源性干細胞組熒光強度值為1.86±0.79,人尿源性干細胞組膠質纖維酸性蛋白熒光強度顯著低于脊髓損傷組(P<0.05),見圖4。
3討論Discussion
3.1人尿源性干細胞生物學特征人尿源性干細胞來源于尿液,是一類具有良好自我增殖和多向分化潛能的成體干細胞,人尿源性干細胞通過旁分泌/自分泌機制減輕腎臟細胞和組織損傷,已知間充質干細胞可以分泌大量具有抑制凋亡、修復細胞損傷的可溶性因子,包括表皮生長因子、重組人神經膠質源神經營養因子、血管內皮生長因子、血小板衍生因子和胰島素樣生長因子結合蛋白等[9-10]。由于人尿源性干細胞具有來源不受限制,制備過程簡便,安全無創和成本低等特點,在細胞替代療法和組織工程研究中更具優勢,而目前國內外對于人尿源性干細胞的研究尚處于初期階段。
研究顯示,第1-4代人尿源性干細胞能高表達細胞表面抗原決定簇CD90、CD105、CD44和CD29,而低表達CD31、CD45、CD133和CD117,細胞表面抗原決定簇能決定細胞的生物學特性[11]。因此,為進一步驗證人尿源性干細胞生物學特性,該研究首先將人尿源性干細胞在體外分別向成軟骨、成骨、神經元樣細胞誘導,發現其能向軟骨、骨及神經元樣細胞分化,提示人尿源性干細胞具有多向分化潛能。通過流式細胞儀檢測細胞表型,發現人尿源性干細胞高表達CD29和CD90,而低表達CD45,提示人尿源性干細胞具有和其他間充質干細胞相似的生物學特性,因此,進一步設想人尿源性干細胞對于脊髓損傷具有一定促進修復作用。
3.2人尿源性干細胞治療脊髓損傷成體干細胞治療脊髓損傷已有較多報道,如骨髓間充質干細胞、脂肪間充質干細胞、人臍血間充質干細胞以及神經干細胞等對于脊髓損傷均有保護作用[12-13]。對于人尿源性干細胞,目前研究多集中于泌尿系疾病,如陰莖海綿體局部神經損傷后導致勃起功能障礙[14]。人尿源性干細胞在體內可分泌血管內皮生長因子促進裸鼠神經對肌肉支配,改善壓力性尿失禁小鼠神經支配功能[15]。對于脊髓損傷的研究尚未有研究報道,該實驗通過Allen法構建大鼠脊髓損傷模型,發現脊髓損傷大鼠后肢運動功能明顯受到抑制,經移植人尿源性干細胞后,后肢運動功能明顯好轉,提示人尿源性干細胞可改善脊髓損傷大鼠后肢的運動功能。
脊髓損傷具有高發病率及高致殘性的特點,是較為棘手的臨床常見疾病,可造成患者神經功能永久性障礙[16-17]。脊髓損傷發生后巨噬細胞聚集、激活并釋放一系列炎性或氧化應激因子,這些細胞因子能夠促使星形膠質細胞和小膠質細胞發生遷移,同時促使星形膠質細胞增殖、肥大,并產生膠質絲和突起,促進神經元細胞變性壞死,最終導致膠質瘢痕形成[18-22]。既往研究已證實膠質瘢痕是影響軸突再生和中樞神經系統損傷后功能恢復的主要障礙[23-25]。該研究中,脊髓損傷后神經元細胞腫脹壞死,嚴重的脫髓鞘樣改變,并出現較多炎性細胞浸潤,脊髓中央空洞形成,膠質纖維酸性蛋白熒光強度較大;而經過人尿源性干細胞移植治療后浸潤的炎性細胞明顯減少,脫髓樣改變也明顯減少,膠質纖維酸性蛋白熒光強度減弱。
半定量分析顯示,人尿源性干細胞移植治療后脊髓損傷缺損面積和致密膠質瘢痕明顯減少,提示人尿源性干細胞移植治療可明顯改善脊髓損傷,其機制可能為:人尿源性干細胞具有干細胞特性,在體外能誘導成神經元樣細胞,植入脊髓損傷區域后,在神經細胞的大環境中能誘導人尿源性干細胞向神經元樣細胞分化;其次,人尿源性干細胞移植后能自發分泌一些細胞營養因子,能夠促進人尿源性干細胞增殖和神經營養作用[26-28];最后,人尿源性干細胞可能具有其他間充質干細胞
相似的抑制炎性反應的生物學特性,能抑制脊髓損傷后相關炎癥因子的分泌[29-31],從而發揮神經元保護作用。目前對于脊髓損傷的治療策略多采取抑制神經元細胞凋亡以及刺激軸突再生等。對于減少炎癥反應微環境及局部膠質瘢痕形成的研究較少,該研究從體外驗證了人尿源性干細胞可分化為神經元樣細胞并在體內可發揮促進脊髓損傷修復的作用,為神經組織工程種子細胞的選擇提供了新的參考。
SCISSCIAHCI