發布時間:2020-02-22所屬分類:醫學論文瀏覽:1次
摘 要: 摘要背景:現有方法將外源分子如DNA導入到人胚胎干細胞用于科學研究的效率普遍較低,如何優化現有條件,提高轉染效率顯得尤為重要。目的:比較兩種不同的傳代方法對人胚胎干細胞系H9轉染效率的影響,優化胚胎干細胞轉染條件。方法:人胚胎干細胞系H9分別采用
摘要背景:現有方法將外源分子如DNA導入到人胚胎干細胞用于科學研究的效率普遍較低,如何優化現有條件,提高轉染效率顯得尤為重要。目的:比較兩種不同的傳代方法對人胚胎干細胞系H9轉染效率的影響,優化胚胎干細胞轉染條件。方法:人胚胎干細胞系H9分別采用小克隆傳代法和單細胞傳代法進行傳代,傳代后繼續培養細胞48h,用Lipofectamine3000轉染pAdTrack-AKT1熒光質粒2d后,熒光顯微鏡下觀察熒光質粒的表達,流式細胞儀檢測人胚胎干細胞的轉染效率;RT-qPCR和Westernblot分別檢測轉染后AKT1在mRNA和蛋白質水平的表達。結果與結論:①熒光顯微鏡下觀察發現單細胞傳代組表達熒光質粒的細胞數量更多,流式細胞儀檢測單細胞傳代法的轉染效率[(47.18±2.00)%]高于小克隆傳代法的轉染效率[(19.52±0.86)%],差異有顯著性意義(P<0.01);②單細胞傳代組轉染后AKT1mRNA和蛋白的表達均高于小克隆傳代組,差異有顯著性意義(P<0.01);③結果表明,采用單細胞傳代法,增加細胞與轉染試劑脂質體的接觸面積可提高人胚胎干細胞的轉染效率。
關鍵詞:人胚胎干細胞;小克隆傳代法;單細胞傳代法;脂質體轉染;轉染效率
0引言Introduction
胚胎干細胞是一類起源于胚胎發育早期囊胚內細胞群中未分化的細胞,具有自我更新、無限增殖和多向分化的潛能[1],故其在醫學上具有非常重要的研究價值與應用前景[2-5]。基因轉染是研究胚胎干細胞生理功能和分化發育機制的重要技術手段[6],但其轉染效率受諸多因素的影響,如細胞狀態、質粒DNA的大小、轉染方法及其操作細節等[7]。目前常用的轉染方法有慢病毒轉染、核電轉、脂質體轉染等[8],其中脂質體轉染無免疫和突變風險[9],是穩定轉染人胚胎干細胞(humanembryonicstemcells,hESCs)的理想試劑。該研究基于脂質體轉染法發現人胚胎干細胞使用單細胞傳代法傳代的細胞轉染效率明顯優于小克隆傳代法。該法簡單穩定有效,將為人胚胎干細胞的轉染提供有力的技術支撐,為人胚胎干細胞的臨床應用研究增添新的方法和策略。
1材料和方法Materialsandmethods
1.1設計細胞學實驗觀察。
1.2時間及地點實驗于2018年7月至2019年4月在徐州醫科大學腦病生物信息重點實驗室完成。
1.3材料
1.3.1實驗材料人胚胎干細胞系H9、pAdTrack-AKT1熒光質粒由作者所在實驗室保存。
1.3.2實驗試劑mTeSR1培養基、消化酶Accutase、Y-27632(STEMCELL公司);基質膠Matrigel(CorningBioCoat公司);轉染試劑Lipofectamine3000、Opti-MEM1減血清培養基、免疫熒光二抗(Invitrogen公司);反轉錄試劑及定量PCR試劑(Takara公司);SOX2、OCT4、AKT1抗體(CellSignalingTechnology公司);定量PCR引物(上海生工合成)。
1.3.3實驗儀器熒光顯微鏡(Olympus,日本);流式細胞儀(BD,美國);激光共聚焦熒光顯微鏡(Zeiss,德國);PCR擴增儀2720ThermalCycler(AppliedBiosystems,美國);穩壓/穩流DNA電泳儀(Bio-Rad,美國);細胞培養箱(Thermo,美國);超凈工作臺(蘇州安泰空氣技術有限公司,中國)等。
1.4實驗方法
1.4.1人胚胎干細胞的復蘇、培養及鑒定采用無飼養層培養條件,細胞培養皿表面均經Matrigel包被過夜。取出凍存于液氮中的人胚胎干細胞系H9,在37℃水浴中快速震蕩溶解至有少許冰殘留;吸取凍存液,逐滴加入人胚胎干細胞培養基mTeSR1,輕搖混勻,1000r/min離心5min后棄上清,用mTeSR1重懸混勻,接種于包被好Matrigel的細胞培養皿表面,每天換液。細胞使用Accutase初步消化后,用槍頭機械刮取細胞碎片,以1∶4的比例傳代,約7d傳代1次。
1.4.2人胚胎干細胞的傳代吸棄培養基,加入復溫的Accutase消化酶,顯微鏡下觀察克隆邊緣的細胞皺縮,克隆內部有裂痕,吸棄Accutase,進行下一步處理:①小克隆傳代法:立即終止消化,加入mTeSR1,用槍頭輕輕吹打使細胞形成細小碎片,接種至6孔板;②單細胞傳代法:將培養皿放入37℃恒溫箱,等待約1min后取出,細胞呈單個狀態,加入含10μmol/LY-27632的mTeSR1輕輕吹打混勻,接種至6孔板,放置于37℃,體積分數為5%CO2培養箱培養。
1.4.3人胚胎干細胞的轉染及轉染效率檢測當細胞匯合度達到30%-60%(傳代48h后)時進行轉染。取2個無菌1.5mLEppendorf管,分別加入125μLOpti-MEM1減血清培養基,其中一管加入適量Lipofectamine3000輕柔混勻;另一管加入pAdTrack-AKT1熒光質粒(10660bp),渦旋混勻后逐滴加入含Lipofectamine3000的混合液中,室溫孵育10-15min,形成脂質體復合物。將脂質體復合物逐滴加入培養基,輕輕搖動細胞培養板,使復合物分散均勻。在37℃,體積分數為5%CO2培養箱內培養48h,流式細胞儀檢測轉染效率。
1.4.4細胞免疫熒光檢測SOX2、OCT4的表達人胚胎干細胞用37℃的PBS洗5遍,40g/L多聚甲醛4℃固定20min,吸棄多聚甲醛,常溫PBS洗后封閉。一抗稀釋于含3%BSA和0.3%Triton-100的PBS(SOX21∶400稀釋,OCT41∶800稀釋),4℃避光過夜,次日室溫30min復溫,常溫PBS清洗后孵育二抗(1∶500稀釋),避光2h,DAPI染核5min,常溫PBS清洗后熒光顯微鏡觀察。
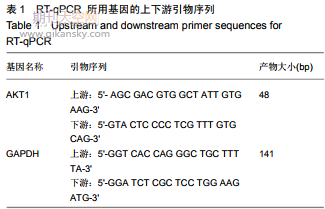
1.4.5實時熒光定量PCR(RT-qPCR)檢測AKT1的mRNA表達Trizol法收集轉染后人胚胎干細胞,按照試劑盒說明書進行實驗,提取總RNA樣本、反轉錄并進行RT-qPCR實驗,檢測AKT1的mRNA水平。RT-qPCR程序為預變性95℃30s;變性95℃5s,退火60℃30s(40次循環);每個樣本均設置3個重復。引物見表1。
1.4.6蛋白質印跡實驗(Westernblot)檢測AKT1的蛋白表達轉染后的人胚胎干細胞加入勻漿液,細胞總蛋白質(20μg)于10%SDS-聚丙烯酰胺凝膠電泳分離,100V電壓轉膜70min,室溫下3%BSA封閉3h,鼠抗人AKT1抗體(1∶2000稀釋)4℃孵育過夜后,鼠二抗(1∶10000稀釋)室溫孵育1h。內參蛋白抗體選用兔抗人GAPDH(1∶2000稀釋)。QuantityOne圖像分析軟件對蛋白條帶進行掃描分析,以GAPDH為參照,AKT1表達的相對含量以目的條帶與內參條帶灰度值的比值表示。
1.5主要觀察指標①熒光顯微鏡觀察人胚胎干細胞轉染AKT1質粒后的熒光表達;②流式細胞儀檢測細胞轉染效率;③RT-qPCR檢測AKT1的mRNA表達;④Westernblot檢測AKT1的蛋白表達。
1.6統計學分析實驗數據均以x_±s表示。組間均數比較采用獨立樣本t檢驗,P<0.05為差異有顯著性意義。統計分析用SPSS16.0軟件,圖表制作用GraphPadPrism7.0軟件。
推薦閱讀:怎么發外文的醫學論文
2結果Results
2.1人胚胎干細胞正常形態及未分化狀態鑒定結果在Matrigal膠上貼壁培養的人胚胎干細胞呈克隆樣生長,細胞排列緊密,核質比高,細胞集落邊緣光滑,生長狀態良好,無邊緣細胞向外明顯延展和核質比降低等分化表現,隨著培養天數增加細胞集落逐漸融合,培養7d時細胞匯合度可達80%-90%,見圖1。通過細胞免疫熒光檢測,人胚胎干細胞均表達其特異性標志物SOX2和OCT4,見圖2。
2.2人胚胎干細胞轉染AKT1質粒后的熒光表達不同方式傳代的人胚胎干細胞在傳代后繼續培養48h,光學顯微鏡下觀察細胞狀態,可見小克隆傳代的細胞之間致密緊湊;單細胞傳代的細胞結構清晰,仍趨向克隆樣生長,細胞與細胞之間連接較松散,見圖3A,D。轉染48h后,使用熒光顯微鏡觀察不同傳代方式的細胞轉染效率,發現在去除ROCK抑制劑Y-27632(可以阻止人胚胎干細胞因分離導致的細胞凋亡,提高單個人胚胎干細胞的存活率)后,單細胞傳代的人胚胎干細胞仍呈克隆樣緊密生長,見圖3E。單細胞傳代后轉染pAdTrack-AKT1熒光質粒48h的熒光細胞數目明顯多于小克隆傳代法,見圖3C,F。流式細胞儀檢測單細胞傳代的人胚胎干細胞轉染效率為(47.18±2.00)%,小克隆傳代的人胚胎干細胞轉染效率為(19.52±0.86)%,單細胞傳代法的轉染效率高于小克隆傳代法(P<0.01,n=5),見圖4。鏡下觀察時也未見明顯分化的細胞,表明單細胞傳代的細胞用脂質體轉染是安全穩定且高效的。
2.3人胚胎干細胞轉染AKT1質粒后其mRNA和蛋白質水平的表達單細胞傳代組AKT1在mRNA和蛋白質的表達水平均顯著高于小克隆傳代組(P<0.01,n=3),見圖5。
3討論Discussion
人胚胎干細胞是非常難轉染的細胞之一,目前常用的轉染方法的效率均較低[10-11]。綜合比較來看慢病毒轉染效率最高,但是病毒轉染具有較大的免疫原性、插入誘變和病毒整合進宿主基因的風險[12-13]。核轉染需要將人胚胎干細胞消化成單個細胞,轉染后細胞存活率低[14],且需購買專用的細胞轉染試劑盒和核轉儀,費用較高。脂質體轉染無免疫和突變風險,轉染效果穩定[15-16],但以往的研究認為該法轉染效率較低。隨著技術改進,脂質體轉染人胚胎干細胞的效率正逐步提高,Lipofectamine2000是一種有效的轉染試劑且在許多研究中應用,而Lipofectamine3000是其新一代的改進產品,與Lipofectamine2000相比其轉染效率更高,細胞毒性更小[17]。影響脂質體轉染效率的因素包括脂質體復合物的形成、與細胞表面的相互作用、DNA的釋放和傳遞到細胞核等。在單層貼壁培養條件下,人胚胎干細胞克隆邊緣的轉染效率高,克隆內部的細胞密集,與轉染試劑的作用面積小,加之細胞本身的外排作用[18],導致大克隆細胞轉染效率低。人胚胎干細胞常規培養呈克隆樣密集生長,單個細胞的存活率較低,而Y-27632可以阻止單個人胚胎干細胞易發生的細胞凋亡,在不影響人胚胎干細胞自我更新和多潛能特性的前提下提高單個人胚胎干細胞的存活率[19],且在轉染之前使細胞處于相對良好的狀態,有利于脂質體復合物與細胞的相互作用,故轉染效率得以提高。人胚胎干細胞使用酶消化單細胞傳代法傳代數代,仍可維持細胞多能性、未分化和遺傳正常狀態[20-23]。也有研究表明使用單細胞傳代5代后可檢測到染色體和核型異常[24],但作者的研究只在轉染時使用單細胞傳代,在常規培養中并不使用單細胞連續傳代,故細胞基因組的穩定性良好。該研究從安全穩定的脂質體轉染法入手,轉染帶綠色熒光標記的AKT1質粒來研究現有條件下如何優化人胚胎干細胞的轉染效率,通過流式細胞儀檢測轉染效率結合RT-qPCR和Westernblot檢測轉染AKT1質粒后其mRNA和蛋白表達水平,結果表明單細胞傳代法降低細胞匯合度和細胞間的緊密程度可明顯提高人胚胎干細胞的轉染效率;同時也發現細胞密度過小,脂質體毒性作用明顯,細胞死亡增多,轉染效率亦不高。因此,轉染前優化細胞狀態對細胞的轉染效率也是至關重要的。
SCISSCIAHCI