發(fā)布時(shí)間:2022-02-15所屬分類:工程師職稱論文瀏覽:1次
摘 要: 摘要: 采用三相法( TPP) 分離純化番薯過(guò)氧化物酶( SPP) ,以番薯過(guò)氧化物酶的酶活回收率和純化倍數(shù)為優(yōu)化目標(biāo),分別利用單因素法和響應(yīng)面分析法對(duì)其影響因素進(jìn)行考察。建立了最佳提取條件: 以叔丁醇作溶劑、硫酸銨飽和度為 66%、粗提物與叔丁醇體積比為 1. 0 ∶1. 13、
摘要: 采用三相法( TPP) 分離純化番薯過(guò)氧化物酶( SPP) ,以番薯過(guò)氧化物酶的酶活回收率和純化倍數(shù)為優(yōu)化目標(biāo),分別利用單因素法和響應(yīng)面分析法對(duì)其影響因素進(jìn)行考察。建立了最佳提取條件: 以叔丁醇作溶劑、硫酸銨飽和度為 66%、粗提物與叔丁醇體積比為 1. 0 ∶1. 13、溫度為 26℃、pH = 5. 0,在最優(yōu)提取條件下,其酶活回收率和純化倍數(shù)分別達(dá) 133. 5%和 3. 5。 SDS-PAGE 電泳分析結(jié)果顯示 SPP 酶蛋白主要為一條帶,其分子質(zhì)量約為 40 kDa 左右。三相法操作簡(jiǎn)便、耗時(shí)短、成本低,此外分離過(guò)程增強(qiáng)了 SPP 酶與底物的親和力,提高了酶活回收率,有利于工業(yè)化應(yīng)用。
關(guān)鍵詞: 三相分離; 番薯過(guò)氧化物酶; 酶活回收率; 純化倍數(shù); 響應(yīng)面分析
過(guò)氧化物酶( Peroxidase,POD,EC1. 11. 1. 7) 是廣泛存在于自然界的一類氧化還原酶,催化有過(guò)氧化氫參與的多種氧化反應(yīng),屬含血紅素的氧化酶。 2007 年,Alpeeva 等 發(fā) 現(xiàn) 番 薯 過(guò) 氧 化 物 酶 ( sweet potato peroxidase,SPP) 較辣根過(guò)氧化物酶在分析檢測(cè)反應(yīng)中具有更高的靈敏度,且發(fā)光時(shí)間長(zhǎng)、穩(wěn)定性高[1]。目前番薯過(guò)氧化物酶在環(huán)保行業(yè)、食品工業(yè)、醫(yī)療診斷、生物傳感器等行業(yè)應(yīng)用普遍[2]。通常利用丙酮分級(jí)分離、雙水相萃取方法將過(guò)氧化物酶初步分離,再利用硫酸銨分級(jí)沉淀法進(jìn)一步純化。但這些分離提純方法存在操作過(guò)程復(fù)雜、耗時(shí)長(zhǎng)、失酶量大、提取率低等缺點(diǎn)。近年來(lái),三相法逐步取代鹽析法應(yīng)用于酶的分離純化,是指在粗酶液中加入鹽和有機(jī)溶劑并將其混勻,離心靜置后分層形成三相,上層有機(jī)相是有機(jī)溶劑,中間沉淀相是酶蛋白沉淀,下層水相主要包含極性化合物。三相法操作簡(jiǎn)便、耗時(shí)短,真正做到了一步分離,酶活回收率和純化倍數(shù)也較其他多步分離方法高,有利于工業(yè)化應(yīng)用[3-7]。目前尚未見(jiàn)關(guān)于利用三相法分離純化番薯過(guò)氧化物酶的研究報(bào)道。
筆者采用三相法分離純化番薯過(guò)氧化物酶,以 SPP 的酶活回收率和純化倍數(shù)為優(yōu)化目標(biāo),利用單因素法和響應(yīng)面分析法對(duì)三相分離的影響因素進(jìn)行考察和優(yōu)化。通過(guò)掃描電鏡( SEM) 觀察分析了酶蛋白沉淀的微觀結(jié)構(gòu),并利用 SDS-PAGE 電泳測(cè)得了 SPP 的分子質(zhì)量。
1 材料、試劑與儀器
1. 1 材料與試劑
番薯( 本地超市購(gòu)買) 。無(wú)水乙醇、叔丁醇、正丁醇、乙腈、異丙醇、1,4-丁二醇、硫酸銨、磷酸氫二鈉、磷酸二氫鈉、愈創(chuàng)木酚、氫氧化鈉、鹽酸、乙二胺四乙酸二鈉、碳酸氫鈉、氯化鈉,AR,國(guó)藥集團(tuán)化學(xué)試劑有限公司生產(chǎn); 考馬斯亮藍(lán)( G250) 、牛血清蛋白,索萊寶生物生產(chǎn)。
1. 2 儀器
80-1 型醫(yī)用離心機(jī),江蘇新康醫(yī)療器械有限公司生產(chǎn); XK96-A 型快速混勻器,上海磊固儀器有限公司生產(chǎn); TU-1901 型紫外-可見(jiàn)分光光度計(jì),北京普析通用儀器有限責(zé)任公司生產(chǎn); PH-100A /100B 筆式 pH 計(jì),邦西儀器科技上海有限公司生產(chǎn); EVO18 掃描電子顯微鏡,德國(guó)蔡司公司生產(chǎn)。
2 實(shí)驗(yàn)方法
2. 1 番薯過(guò)氧化物酶粗提液的制備
將新鮮番薯皮洗凈曬干,用攪拌器粉碎,過(guò) 200 目篩。取適量攪碎的番薯皮加入其 4 倍體積的蒸餾水,室溫浸泡 2 h 后,用 4 層紗布過(guò)濾并收集濾液,將其所剩濾渣復(fù)提 1 次,再合并 2 次所得濾液,在 4 000 r /min 下離心 10 min,收集上層清液即為番薯過(guò)氧化物酶粗提液,放入 4℃冰箱中保存?zhèn)溆谩?/p>
2. 2 三相法分離純化番薯過(guò)氧化物酶
取一定體積的粗提液,邊震蕩邊加入研磨后的硫酸銨使粗提液達(dá)到一定飽和度,持續(xù)震蕩 2 min 使其完全溶解,按一定體積比加入有機(jī)溶劑用混勻器混勻后于室溫靜置 1 h,逐漸形成三相體系。將體系在 4 000 r /min 下離心 10 min,使中間相濃縮成片狀蛋白沉淀。除去上層有機(jī)相和下層水相,并收集中間沉淀相,依次用少量清水和緩沖液淋洗,即得番薯過(guò)氧化物酶。用適量 pH = 6. 0 磷酸鹽緩沖溶液 ( PBS) 使 中 間 沉 淀 相 溶 解,蒸餾水稀釋定容至 10 mL,對(duì)其酶活和蛋白濃度進(jìn)行測(cè)定分析。
分別考查溶劑類型、硫 酸 銨 飽 和 度 ( 30% ~ 80%) 、溶劑用量( 1 ~ 8 mL) 、溫度( 20 ~ 40℃ ) 、pH ( 3 ~ 8) 等因素對(duì)番薯過(guò)氧化物酶的酶活回收率和純化倍數(shù)的影響。
2. 3 響應(yīng)面分析法優(yōu)化三相分離提取工藝
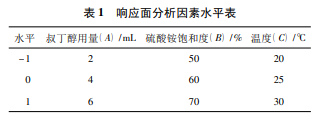
在單因素考察結(jié)果的基礎(chǔ)上,選取叔丁醇用量 ( A) 、硫酸銨飽和度( B) 、溫度( C) 3 個(gè)因素為自變量,以酶活回收率和純化倍數(shù)為響應(yīng)值,進(jìn)行 3 因素 3 水平的響應(yīng)面分析。利用 Design - Expert 8. 0. 6 Trial 應(yīng)用軟件對(duì)實(shí)驗(yàn)進(jìn)行設(shè)計(jì),并對(duì)響應(yīng)結(jié)果進(jìn)行分析 處 理[8-9]。響應(yīng)面分析因素與水 平如表 1 所示。
2. 4 番薯過(guò)氧化物酶酶活力的測(cè)定
利用愈創(chuàng)木酚法測(cè)定番薯過(guò)氧化物酶的活力[2]。取 2. 0 mL 含 0. 045 mol /L 愈創(chuàng)木酚和 0. 05 mol /L 的過(guò)氧化氫,pH= 6. 0 的 PBS 緩沖液,再加入 100 μL 酶液。利用紫外-可見(jiàn)分光光度計(jì)檢測(cè)在 90 s 時(shí) SPP 在 470 nm 處的吸光度變化值。
酶活力的定義: 以 25℃下每分鐘轉(zhuǎn)化 1 μmol 底物定義為一個(gè)酶活單位( U) 。
2. 5 蛋白濃度的測(cè)定
采用 Bradford 法 進(jìn) 行 測(cè) 定,以 牛 血 清 蛋 白 ( BSA) 為標(biāo)準(zhǔn)蛋白[10]。
2. 6 掃描電鏡分析( SEM)
將粗酶液、三相分離法得到的中間沉淀相和三相分離過(guò)程得到的下層水相進(jìn)行透析處理,真空冷凍干燥 24 h,用 S-4800 型高分辨場(chǎng)發(fā)射掃描電鏡對(duì)其蛋白沉淀的結(jié)構(gòu)進(jìn)行觀測(cè)及分析。
2. 7 SDS-PAGE
SDS-PAGE 采用 Laemmli 法進(jìn)行測(cè)定[11]。
3 結(jié)果與討論
3. 1 三相分離的單因素優(yōu)化
3. 1. 1 溶劑對(duì) SPP 三相分離結(jié)果的影響
通過(guò)正丁醇、乙腈、叔丁醇、異丙醇和 1,4-丁二醇考察有機(jī)溶劑對(duì) SPP 三相分離效果的影響,結(jié)果如表 2 所示。由表 2 可以看出,在硫酸銨飽和度為 60%、pH = 5. 0、溫度為 20℃、溶劑用量與粗酶液等體積條件下,用叔丁醇作溶劑時(shí)酶活回收率和純化倍數(shù)達(dá)最高,分別為 130. 8%和 2. 4。叔丁醇可以降低體系的介電常數(shù),增大酶蛋白上帶電基團(tuán)間的靜電作用力,促使其發(fā)生聚集而形成三相。此外,叔丁醇有較高的分子尺寸而不會(huì)滲透到酶蛋白折疊的三維結(jié)構(gòu)內(nèi),因此不會(huì)引起酶的變性[12]。三相法大大提高了 SPP 的酶活回收率( 大于 100%) ,這是由于在三相分離過(guò)程中改變了酶的構(gòu)象,使其變得與底物更為親和。
3. 1. 2 硫酸銨飽和度對(duì) SPP 三相分離結(jié)果的影響
硫酸銨飽和度在三相分離中起著重要作用,因?yàn)槠湄?fù)責(zé)蛋白間的相互作用,利用鹽析機(jī)理使蛋白沉淀。在快速震蕩、pH = 5. 0、溫度為 20℃ 的條件下,改變硫酸銨飽和度從 30%增加至 80%,并按體積比 1 ∶1加入叔丁醇。硫酸銨飽和度對(duì) SPP 三相分離的 影 響 如 表 3 所 示。由 表 3 可 以 看 出,隨 著 ( NH4 ) 2 SO4 飽和度的增加,SPP 的酶活回收率和純化倍 數(shù) 在 飽 和 度 為 60% 時(shí) 達(dá) 最 高 點(diǎn),分 別 為 139. 5%和 2. 7。( NH4 ) 2 SO4 飽和度進(jìn)一步增加時(shí),中間相的 SPP 的選擇性分配減少,酶活回收率和純化倍數(shù)降低,也許是過(guò)高的硫酸銨飽和度會(huì)導(dǎo)致酶失活的原因。
3. 1. 3 叔丁醇用量對(duì) SPP 三相分離結(jié)果的影響
在硫酸銨飽和度為 60%、pH = 5. 0、溫度為 20℃ 時(shí),粗提液與叔丁醇的體積比對(duì) SPP 三相分離的影響如表 4 所示。由表 4 可以看出,隨著叔丁醇用量的增加,SPP 的酶活回收率和純化倍數(shù)均先增加后減少,體積比為 1 ∶ 1時(shí)酶活回收率和純化倍數(shù)達(dá)最高,分別為 128. 0%和 1. 8。體系中加入叔丁醇后,其從水相中吸引了更多的水,水相中的鹽濃度增加,使酶蛋白在界面處沉淀。但繼續(xù)增加叔丁醇用量,兩相之間的濃度梯度減小,反而降低了 SPP 的分離效果。
3. 1. 4 溫度對(duì) SPP 三相分離結(jié)果的影響
溫度是影響酶和體系整體穩(wěn)定性的重要參數(shù)。在粗酶與叔丁醇體積比為 1 ∶ 1、硫酸銨飽和度為 60%、pH = 5. 0 的條件下,溫度對(duì) SPP 三相分離結(jié)果的影響如表 5 所示。由表 5 可以看出,隨著溫度的升高,酶活回收率和純化倍數(shù)先增加后減小。在 25℃時(shí) SPP 的酶活回收率和純化倍數(shù)達(dá)最高,分別為 123. 6%和 3. 3。在 20 ~ 25℃條件下,叔丁醇會(huì)產(chǎn)生明顯的滲透性和擁擠效應(yīng),增強(qiáng) SPP 的分配,而溫度為 25℃以上時(shí),滲透和擁擠效應(yīng)明顯減弱,酶的熱失活反而使酶活性和純化因子降低[11]。
3. 1. 5 pH 對(duì) SPP 三相分離結(jié)果的影響
pH 的變化促進(jìn)了目標(biāo)蛋白質(zhì)凈電荷的變化并影響蛋白質(zhì)的分配行為[13]。在( NH4 ) 2 SO4 飽和度為 60%、粗酶液與叔丁醇體積比為 1 ∶1、溫度為 25℃ 的條件下,研究不同 pH( 3 ~ 8) 對(duì)番薯過(guò)氧化物酶三相分離的影響,結(jié)果如表 6 所示。由表 6 可以看出,在 pH = 5. 0 時(shí)獲得了最高酶活回收率和純化倍數(shù),分別為 133. 9%和 3. 4,所以 pH = 5. 0 為三相分離中的最佳驗(yàn)點(diǎn)。
3. 2 響應(yīng)面分析法優(yōu)化 SPP 三相分離提取工藝
試驗(yàn)組的試驗(yàn)方案及結(jié)果如表 7 所示。回歸模型方差分析結(jié)果如表 8 所示。
3. 2. 1 各因子交互作用對(duì) SPP 酶活回收率的影響
各因子交互作用對(duì) SPP 酶活回收率的交互影響如圖 1 所示。由圖 1 可以看出,溫度和硫酸銨飽和度的交互作用對(duì)酶活回收率的影響較大。由等高線圖可以看出,沿硫酸銨飽和度軸向的等高線變化密集,而沿溫度軸向等高線變化稀疏,說(shuō)明硫酸銨飽和度對(duì)酶活回收率大小的影響比溫度更大。由 Box -Behnken Design 軟件分析得到較高酶活回收率的三相分離提取的最佳工藝結(jié)果為: 叔丁醇用量為 4. 06 mL( 粗酶液體積為 4 mL) ,硫酸銨飽和度為 64. 91%,溫度為 25. 87℃,理論上預(yù)測(cè)酶活回收率大小為 133. 5%。
3. 2. 2 各因子交互作用對(duì) SPP 純化倍數(shù)的影響
各因子交互作用對(duì) SPP 純化倍數(shù)的交互影響如圖 2 所示。由圖 2 可以看出,硫酸銨飽和度和叔丁醇的交互作用對(duì)純化倍數(shù)的影響較大。由等高線圖中可以看出,沿叔丁醇用量軸向的等高線變化密集,而沿硫酸銨飽和度軸向的等高線變化稀疏,說(shuō)明叔丁醇用量比硫酸銨飽和度更能影響純化倍數(shù)的大小。由 Box-Behnken Design 軟件分析得到較高純化倍數(shù)的三相分離提取的最佳工藝結(jié)果為: 叔丁醇用量為 4. 8 mL ( 粗 酶 液 體 積 4 mL) ,硫酸銨飽和度為 64. 59%,溫度為 25. 49℃,理論上預(yù)測(cè)純化倍數(shù)大小為 3. 5。
3. 3 掃描電鏡( SEM) 形貌分析
粗提法和三相法所得 SPP 酶的 SEM 圖如圖 3 所示。
由圖 3 可以看出,粗提液中 SPP 酶蛋白沉淀的微觀形態(tài)結(jié)構(gòu)為聚集在一起的球狀顆粒。而三相分離法形成的 SPP 酶蛋白沉淀的微觀形態(tài)結(jié)構(gòu)主要為光滑的片狀結(jié)構(gòu)。三相分離法所得的 SPP 是由于硫酸銨和叔丁醇的共同作用,受多方面作用力影響而形成較明顯的片狀結(jié)構(gòu),并遷移到中間相并沉淀。
3. 4 SDS-PAGE 電泳分析
將三 相 分 離 法 所 得 的 SPP 溶 液 進(jìn) 行 SDS - PAGE 電泳分析,結(jié)果如圖 4 所示。由圖 4 可以看出,番薯過(guò)氧化物酶的分子質(zhì)量大小為 40 kD 左右,該分子質(zhì)量在不同來(lái)源的過(guò)氧化物酶的分子質(zhì)量范圍之內(nèi)[14-15]。三相法分離所得到的酶蛋白沉淀的球狀顆粒周圍的雜蛋白含量相較于粗提液明顯要少。
4 結(jié)論
以酶活回收率和純化倍數(shù)為考察指標(biāo),對(duì)三相法提取番薯過(guò)氧化物酶的工藝條件進(jìn)行優(yōu)化。在單因素實(shí)驗(yàn)的基礎(chǔ)上,選取叔丁醇用量、硫酸銨飽和度、溫度 3 個(gè)因素為自變量,以酶活回收率和純化倍數(shù)為響應(yīng)值,根據(jù) Box-Behnken 設(shè)計(jì)原理,采用 3 因素 3 水平的響應(yīng)面分析法確定最佳工藝。結(jié)果表明,以叔丁醇為溶劑,在硫酸銨飽和度為 66%,粗提物與叔丁醇體積比為 1. 0 ∶ 1. 13,溫度為 26℃,pH = 5. 0 的條件下,其酶活回收率和純化倍數(shù)分別達(dá) 133. 5%和 3. 5。三相法操作簡(jiǎn)便、耗時(shí)短、成本低,此外分離過(guò)程增強(qiáng)了 SPP 酶與底物的親和力,大大提高了酶活回收率,有利于工業(yè)化應(yīng)用。——論文作者:蔡 燕,姜路云,陳華旺,韓麗瑋* ,吳錦明
參考文獻(xiàn)
[1]Alpeeva I,Sakharov I.Liminol-hydrogen peroxide chemiluminescence produced by sweet potato peroxidase[J]. Luminescence,2007,22 ( 2) : 92-96.
[2]Leon J,Alpeeva I,Chubar T,et al.Purification and substrate specificity of Peroxidase from sweet potato tubers[J]. Plant Science, 2002,163( 5) : 1011-1019.
[3]Kosman J,Juskowiak B. Peroxidase-mimicking DNAzymes for biosensing applications: A review[J].Analytica Chimica Acta,2011, 707( 1-2) : 7-17.
[4]Patil P,Yadav G. Application of microwave assisted three phase partitioning method for purification of laccase from Trametes hissuta [J].Process Biochemistry,2018,65: 220-227
.[5]Mangesh D,Virendra K.Three phase partitioning: A novel technique for purification of peroxidase from orange peels[J]. Food and Bioproducts Processing,2015,94: 284-289.
[6]Yan J,Wang Y,Qiu W,et al. Ultrasound synergized with threephase partitioning for extraction and separation of corbicula fluminea polysaccharides and possible relevant mechanisms[J].Ultrasonics Sonochemistry,2018,40: 128-134.
[7]Yadav N,Gupta M,Khare S. Three phase partitioning and spectroscopic characterization of bioactive constituent from halophilic Bacillus subtilis EMB M15[J]. Bioresource Technology,2017,242: 283-286.
[8]Li D,Zheng D,Cao Z.Response surface methods for slope reliability analysis: Review and comparison[J]. Engineering Geology,2016, 203( 25) : 3-14.
[9]Yusri I,Majeed A,Mamat R,et al. A review on the application of response surface method and artificial neural network in engine performance and exhaust emissions characteristics in alternative fuel [J].Renewable and Sustainable Energy Reviews,2018,90: 665- 686.
[10]Bradford M.A rapid and sensitive method for the quantification of microgram quantities of protein using the principle of protein-dye binding[J].Analytical Biochemistry,1976,72( s 1-2) : 248-254.
[11]Laemmlli U.Cleavage of structural proteins during assembly of head of bacteriophage-T4[J].Nature,1970,227: 680-685.
[12]Wang S,Wu P,Han Z. Random conjugated polybenzazole copolymers: Synthesis,characterization,and exciton confinement effects in photophysical properties[J].Journal of Materials Science,2004,39 ( 8) : 2717-2726.