發布時間:2022-01-26所屬分類:農業論文瀏覽:1次
摘 要: 摘 要:采用組織分離法分離江蘇省宿遷市多肉植物青星美人的黑腐病病原菌,通過形態學觀察、rDNAITS 序列分析和致病性測定,確定病原菌的分類學地位,并測定溫度、pH、光照、碳源和氮源對病原菌菌絲生長和產孢量的影響。結果表明:引起宿遷地區青星美人黑腐病的致病病原
摘 要:采用組織分離法分離江蘇省宿遷市多肉植物青星美人的黑腐病病原菌,通過形態學觀察、rDNA–ITS 序列分析和致病性測定,確定病原菌的分類學地位,并測定溫度、pH、光照、碳源和氮源對病原菌菌絲生長和產孢量的影響。結果表明:引起宿遷地區青星美人黑腐病的致病病原菌為暹羅炭疽菌(Colletotrichum siamense),該病原菌最適菌絲生長和產孢量的溫度為 30 ℃,5 ℃時菌絲生長極其緩慢并停止產孢,40 ℃時菌絲死亡并停止產孢;菌絲生長的最適 pH 5.0,產孢的最適 pH 7.0;病原菌能利用多種碳源和氮源,麥芽糖為菌絲生長和產孢的最佳碳源,蛋白胨為產孢最佳氮源,酵母浸膏為菌絲生長最佳氮源,硫酸銨對菌絲生長和產孢有抑制作用;光暗交替適合菌絲生長,連續黑暗適合產孢。
關 鍵 詞:青星美人;黑腐病;暹羅炭疽菌;生物學特性
多肉植物青星美人(Pachyphytum ‘Dr Cornelius’) 是景天科(Crassulaceae)厚葉草屬(Pachyphytum)和擬石蓮花屬(Echeveria)的屬間雜交種,原產于墨西哥[1],是江蘇宿遷種植的主要多肉植物品種。近年來,青星美人黑腐病發生較為嚴重,已成為宿遷多肉植物產區的主要病害,嚴重影響青星美人的品質和種植規模。青星美人植株的根、莖、葉、花等部位均可能染病,葉片受害后先褪色、變軟、水化、枯萎,然后整張葉片迅速發黑腐爛,最后造成植物整株死亡;因此,明確青星美人黑腐病原菌種類及其生物學特性,對青星美人黑腐病的防控具有重要意義。目前,有關多肉植物黑腐病病原結論不一:王貝貝[2]曾從山東青州地區景天科多肉植物雪蓮上分離出黑腐病的病原菌為 Fusarium inflexum ;劉浩等[3]研究認為,多肉植物彩虹黑腐病病原菌為 Fusarium oxysporum;姚錦愛等[4]認為福建漳州景天科多肉植物翡翠景天黑腐病病原菌為山扁豆生棒孢(Corynespora cassiicola)。可見,不同多肉植物的黑腐病是由不同病原菌侵染造成的。筆者從江蘇省宿遷市耿車鎮多肉植物種植基地采集青星美人的黑腐病典型病株,分離、純化病原菌,采用形態學觀察、rDNA–ITS 基因序列分析和致病性測定相結合的方法進行病原鑒定,并對病原菌進行生物學特性研究,以期為多肉植物青星美人黑腐病的防控提供科學依據。
1 材料與方法
1.1 材料
于 2019 年 8 月采集宿遷市耿車鎮多肉植物種植基地的青星美人黑腐病典型癥狀的病害標本,保存于宿遷學院園林專業植物病理實驗室。
1.2 方法
1.2.1 青星美人黑腐病病原菌的分離及鑒定
參照文獻[5]的方法,采用室內組織分離法獲得青星美人黑腐病病原菌株,并于 26 ℃ 保存在 PDA 斜面培養基,備用。
將病原菌接種到 PDA 平板上,培養 5 d,觀察菌落形態、顏色及菌絲生長狀況;培養 10 d 后,在光學顯微鏡下觀察分生孢子和菌絲附著胞的形態特征。應用真菌基因組 DNA 提取試劑盒(南京擎科生物科技有限公司產品,型號 D2300–50T)提取病原菌株的基因組 DNA。用 rDNA–ITS 基因通用引物 ITS1/ITS4(ITS1,5'–TCCGTAGGTGAACCTGCGG– 3';ITS4,5'–TCCTCCGCTTATTGATATGC–3')PCR 擴增。反應條件:95 ℃預變性 5 min;95 ℃變性 15 s,50 ℃退火 20 s,72 ℃延伸 40 s,40 個循環,最后 72 ℃延伸 5 min。按 Axygen DNA 凝膠回收試劑盒(目錄號 AP–GX–50)說明書操作回收 PCR 擴增產物,送至南京金斯瑞生物科技有限公司測序。對所獲得的基因序列,在 NCBI 網站進行 BLAST 同源性比對。通過比對選取相似度高的20 條基因序列,利用 MEGA 6.0 軟件進行系統發育樹的構建。
1.2.2 病原菌致病性的測定
挑選培育期約 1 年、株高 12~15 cm 的健康盆栽青星美人植株用于致病性測定。選取青星美人植株中部健葉,用無菌水反復沖洗,用 75%的乙醇消毒 3 s,用 0.1%的 HgCl2溶液消毒 3 min,再用無菌水沖洗 3~4 次,最后用滅菌的吸水紙吸干表面的水分。用無菌針頭輕輕刺傷消毒處理過的青星美人葉片上表皮,在傷口處敷上 3 mm×3 mm 待測菌株的菌絲塊,以無菌 PDA 瓊脂塊接種作對照。將接種的青星美人葉片置于 26 ℃的植物氣候箱內,12 h 光照加 12 h 黑暗處理,觀察發病情況。將發生黑腐病典型癥狀的青星美人葉片病組織再次分離,并進行形態學觀察和分子鑒定。
1.2.3 病原菌生物學特性的測定
選用 PDA 平板,pH 為 7.0,設置 5、10、15、 20、25、30、35、40 ℃ 共 8 個溫度梯度,3 次重復。用滅菌打孔器取直徑為 5 mm 的菌盤,移至平板正中央,置于全黑暗條件下培養 5 d,每個菌落測定 3 個方向直徑,取平均值,計算菌絲生長速率,培養 10 d 后每皿加入 10 mL 無菌水洗脫孢子,用血球計數板法[6]測定產孢量。
用 1 mol/L 的 HCl 和 1 mol/L 的 NaOH 將 PDA 培養基分別調節成 pH 為 3.0、4.0、5.0、6.0、7.0、 8.0、9.0、10.0、11.0,共 9 個處理,3 次重復,在 26 ℃下測定菌絲生長速率和產孢量。
選用 PDA 培養基,pH 為 7.0,設置 24 h 連續黑暗、24 h 連續光照和光暗交替(12 h 光照加 12 h黑暗)3 個處理,3 次重復,在 26 ℃下測定菌絲生長速率和產孢量。
參照胡永亮等[7]的方法,采用真菌生理培養基 (MgSO4·7H2O 0. 5 g,KH2PO4 0. 5 g,瓊脂 20 g,碳源 5 g,氮源 1 g,蒸餾水 1000 mL),分別以木糖醇、蔗糖、可溶性淀粉、D–果糖、葡萄糖和麥芽糖為碳源,以不加碳源培養基為對照;分別以尿素、酵母浸膏、硫酸銨、蛋白胨、甘氨酸和脯氨酸為氮源,以不加氮源培養基為對照,在 26 ℃下測定菌絲生長速率和產孢量。
2 結果與分析
2.1 青星美人黑腐病病原菌的鑒定結果
青星美人黑腐病病原菌為害植株根部、莖稈和葉片,莖稈和葉片發病較重。葉片多從基部開始發病,病葉退綠、軟化并逐漸化水,發病部位開始出現黑斑,病斑逐漸擴大至全葉,發病后期葉片上出現黑褐色小點(病征),腐爛脫落(圖 1)。
分離純化后菌株的培養性狀如圖 2 所示。菌落正面(圖 2–1)產生淺灰白色氣生菌絲,菌絲發達且較為致密;菌落背面(圖 2–2)為淺灰白色,菌落正中央略帶淡黃色;菌絲附著胞(圖 2–3)為棕褐色,近圓形或橢圓型,邊緣完整、平滑或不規則;分生孢子(圖 2–4)近圓柱狀,一端鈍圓,另一端鈍圓或稍尖細。根據病原菌的形態學特征,結合楊友聯等[8]、李楊[9]、王杰等[10]、徐丹丹等[11]和 SOARES 等[12]的描述,初步判定該菌株可能屬于膠孢炭疽復合種 (Colletotrichum gloeosporioides species complex)或暹羅炭疽復合種(Colletotrichum siamense species complex)。 1 菌落正面;2 菌落背面;3 菌絲附著胞;4 分生孢子。圖 2 青星美人黑腐病病原菌的形態特征 Fig.2 The morphological characteristic of black rot pathogen in Pachyphytum ‘Dr Cornelius’ 以分離得到的病原菌株 DNA 為模板,基于通用引物 IST1 和 IST4 進行 PCR 擴增,得到的 ITS 基因泳帶大小在 500 bp 以上。測序結果表明,該 PCR 產物擴增的目的基因片段序列全長為 543 bp。在 NCBI/BLAST 上對該菌株(J257–01)的基因序列進行同源性比對,發現其與暹羅炭疽菌 C. siamense 模式菌株序列(Gene accession No. KM268865.1, KC702973.1, MH939973.1,KX786431.1,MH939974.1, MH939977.1,MT229430.1)相似度達 100%;與 fungal sp. 模式菌株序列 (Gene accession No. MG490812.1,MG490789.1, MG490768.1,MG490759.1) 相似度為 99%;與 C. tropicale 模式菌株序列(Gene accession No. MK330040.1)相似度為 99%。從 NCBI/ GenBank 中選取近源菌株 rDNA–ITS 基因序列,以 Colletotrichum parsonsiae 菌株(Gene accession No. MH865006.1)作為外群序列構建系統發育樹,結果(圖 3)表明,選取的近源 DNA 序列分屬于 4 個不同的進化分支,C. siamense 與 C. tropicale 親緣關系比較近,在進化上屬于同一分支,引起青星美人黑腐病的菌株 PCR 擴增產物與 C. siamense 屬于同一分支,可以確定引起青星美人黑腐病的菌株為暹羅炭疽菌(Colletotrichum siamense)。
2.2 青星美人黑腐病病原菌的致病性
將純化后菌株的菌絲接種于健康的青星美人葉片,定期觀測發病情況:圖 4–1 為對照,可見葉片仍保持綠色,葉片不發病,僅在接種傷口處出現黑褐色的氧化斑點,隨著時間的增加,氧化斑點沒有增大。圖 4–2 和圖 4–3 為接菌葉片,接菌 2 d 后,葉片泛黃,出現水化現象,接菌口處開始出現黑斑,病斑直徑 3.0~3.5 mm;接菌 5 d 后,葉片變得透明,全化水,黑斑覆蓋整張葉片,葉片上出現黑褐色小點(病征)。將接種發病的青星美人葉片再次進行分離鑒定,獲得的菌株與原接種菌株一致,可判定青星美人黑腐病的致病菌為暹羅炭疽菌 (C. siamense)。
2.3 青星美人黑腐病菌的生物學特性
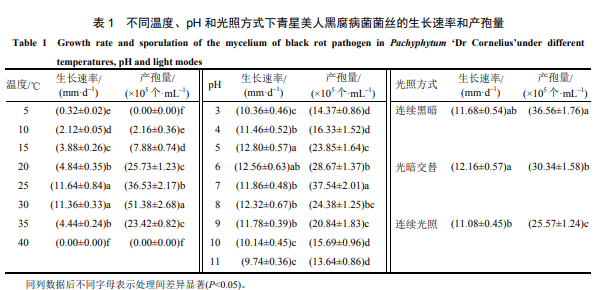
2.3.1 溫度、pH 和光照方式對菌絲生長和產孢數量的影響
由表 1 可知,不同溫度對青星美人黑腐病菌的菌絲生長和產孢量有影響,5~35 ℃時,菌絲均能生長,25 ℃和 30 ℃時菌絲生長速率較大,分別比 10 ℃ 時的菌絲生長速率提高了 449.06%和 435.85%,顯著高于其他溫度下的菌絲生長速率;10~35 ℃時,病菌均能產孢,最適產孢溫度為 30 ℃,其產孢量比 10 ℃時的產孢量增加了 2278.70%,顯著大于其他溫度下的產孢量。5 ℃時,菌絲生長極其緩慢,比 10 ℃ 時的菌絲生長速率減少了 84.91%,停止產孢;40 ℃ 時,菌絲死亡,停止產孢。
菌絲在 pH3~11 的培養基上均能較好生長,pH 值為 11 時,菌絲生長速率最小,pH 值為 5 時菌絲生長速率最大,比 pH 為 11 時的菌絲生長速率提高了 31.42%,與 pH 值為 6 時的菌絲生長速率無顯著差異,但顯著高于其他 pH 下的菌絲生長速率。pH 值為 11 時產孢量最小,pH 值為 7 時產孢量最高,比 pH11 時的產孢量增加了 175.22%,顯著高于其他 pH 下的產孢量。
連續光照方式下菌絲的生長速率和產孢量最低,光暗交替方式下菌絲生長速率最大,比連續光照方式下的菌絲生長速率增加了 9.75%,但與連續黑暗下的菌絲生長速率無顯著差異;3 種光照條件下的產孢量存在顯著差異,連續黑暗最適合產孢,產孢量比連續光照方式下的產孢量提高了 42.98%。
2.3.2 碳源和氮源對菌絲生長和產孢量的影響
由表 2 可知,不同碳源培養基上的菌絲生長速率均顯著大于對照,以麥芽糖和蔗糖為碳源的菌絲生長速率較大,分別比對照增加了 40.70%和 38.67%,顯著大于木糖醇和葡萄糖,與可溶性淀粉和 D–果糖之間無顯著差異;不同碳源培養基上的產孢量均顯著大于對照,麥芽糖為最適產孢碳源,產孢量比對照增加了 71.36%,顯著高于其他碳源。
以硫酸銨為氮源的菌絲生長速率和產孢量顯著小于對照,分別比對照減少了 17.29%和 19.94%;酵母浸膏為菌絲生長最適氮源,其菌絲生長速率比對照增加了 32.82%,與蛋白胨之間無顯著差異,但顯著大于其他氮源;蛋白胨為最適產孢氮源,其產孢量比對照增加了 60.31%,顯著高于其他氮源的。
3 結論和討論
本研究結果表明,江蘇省宿遷市耿車鎮多肉植物種植基地青星美人黑腐病致病菌為暹羅炭疽菌(C. siamense)。該病害主要發病期為 5—9 月,病原菌對酸堿環境的適應性都較強,連續光照可有效抑制病害發生,硫酸銨對菌絲生長和產孢有抑制作用。
暹羅炭疽菌是膠孢炭疽菌(C. gloeosporioides) 復合種之一,最早于 2009 年在泰國咖啡上被發現,可引發咖啡炭疽病[13],隨后大量由暹羅炭疽菌侵染植物引發病害的相關報道,如楊友聯等[8]認為,暹羅炭疽菌可以引起水果采摘后的炭疽病;李沛利等[14] 認為,暹羅炭疽菌可引起鵝掌柴炭疽病;李河等[15] 認為,暹羅炭疽菌可引起油茶苗圃炭疽病;韓曉勇等[16]報道,暹羅炭疽菌可引起紫山藥炭疽病,另有國外學者報道暹羅炭疽菌可引起刺桐、山藥和辣椒等植物的炭疽病[17–19]。從這些報道可知暹羅炭疽菌侵染植物引起的病害為炭疽病,但筆者發現暹羅炭疽菌侵染多肉植物青星美人可引發黑腐病。劉麗萍等[20]認為,炭疽菌屬病原菌在致病過程中形成附著胞的同時,會合成一種次生代謝物質——黑色素。
黑色素除了影響病菌的致病力外,還會使植物葉片黑化[21–22]。羅敦文[23]發現,暹羅炭疽菌能夠引起疲蘿蜜‘瓊引號’幼果蒂腐爛病。劉麗萍等[20]認為,炭疽菌屬病原真菌屬于半活體營養寄生物,而在侵入寄主植物前期,并不立即殺死植物,營活體營養寄生;在入侵后期,隨著侵染菌絲的蔓延,殺死植物,營死體營養寄生。由此可知,暹羅炭疽菌在侵染植物后會導致植物發黑、腐爛、死亡,所以暹羅炭疽菌在侵染青星美人初期葉片黃化,隨著病菌在植株體內大量繁殖后導致葉片開始出現發黑、腐爛、死亡等癥狀。姚錦愛等[4]研究表明,常引起植物葉片褐斑病的山扁豆生棒孢菌也可引發多肉植物的黑腐病,該結果與本研究結果都屬于病原菌侵染多肉植物引起非典型性癥狀病害案例,這可能與多肉植物葉片肥厚、肉質多汁且含水量大等特點有關。暹羅炭疽菌侵染青星美人引發黑腐病的致病機理還需要進一步研究。
本研究結果顯示,10~35 ℃時,青星美人黑腐病病原菌暹羅炭疽菌菌絲生長和產孢均正常,5 ℃ 時菌絲生長極其緩慢,停止產孢,40 ℃時菌絲死亡,停止產孢。最適菌絲生長和產孢的溫度為 30 ℃,這與苗曦予[24]的研究結果一致,說明青星美人黑腐病最適的發病氣溫為 25~30 ℃,江蘇省宿遷 5—9 月的氣溫恰好與青星美人黑腐病發生適宜氣溫耦合。青星美人黑腐病病原菌暹羅炭疽菌對 pH 的適應范圍較廣,pH 值 3~11 時,菌絲生長良好,pH 值 5 時,菌絲生長速率最大;pH 值 5~9 時,產孢量較大,pH 值 7 時,產孢量最大,該結果與李楊[9] 從海南省油茶及其林下植物上分離出的暹羅炭疽菌在 pH 值 4~11 菌絲生長良好的結果相似,可見青星美人黑腐病菌對酸堿環境的適應性較強。適合青星美人黑腐病病原菌暹羅炭疽菌菌絲生長和產孢的最佳碳源為麥芽糖,最佳氮源為蛋白胨,硫酸銨對菌絲生長和產孢有抑制作用,光暗交替適合菌絲生長,連續黑暗更適合病原菌產孢,但苗曦予[24] 研究認為,蘭嶼肉桂炭疽病病原菌暹羅炭疽菌最適菌絲生長和產孢氮源為蛋白胨,最適菌絲生長碳源為 α–乳糖,最佳產孢碳源為葡萄糖,連續黑暗適合菌絲生長,光暗交替適合產孢,這可能是因為不同寄主植株、不同地理來源、同種菌株的生態適應性不同[25]的緣故。——論文作者:王芳,王曉立,韓浩章,張穎,張麗華
參考文獻:
[1] 張靖瑤,朱煜,趙偉,等.多肉青星美人葉片扦插繁殖體系初探[J].現代園藝,2019(21):24–26. ZHANG J Y,ZHU Y,ZHAO W,et al.Preliminary study on the leaf cutting propagation system of succulent plant Pachyphytum ‘Dr Cornelius’[J].Xiandai Horticulture, 2019(21):24–26.
[2] 王貝貝.景天根際促生菌的篩選、基因組測序及培養基優化[D].泰安:山東農業大學,2018. WANG B B . Screening , genome sequencing and optimization of medium and of PGPR from the rhizosophere of Crassulaceae plants[D].Tai’an,China: Shandong Agricultural University,2018.
[3] 劉浩,楊爽,田佩玉,等.多肉植物彩虹黑腐病病原菌的分離鑒定[C]//彭友良.中國植物病理學會 2019 年學術年會論文集.北京:中國農業科學技術出版社, 2019:199. LIU H,YANG S,TIAN P Y,et al.Isolation and identification of the pathogen of succulent rainbow black rot[C]//PENG Y L.Proceedings of the 2019 Annual Meeting of the Chinese Society of Plant Pathology. Beijing:China Agricultural Science and Technology Press,2019:199.
[4] 姚錦愛,黃鵬,陳漢鑫,等.多肉植物翡翠景天黑腐病病原菌[J].菌物學報,2020,39(2):452–456. YAO J A,HUANG P,CHEN H X,et al.Black rot pathogen of succulent plant Sedum morganianum[J]. Mycosystema,2020,39(2):452–456.
[5] 方中達.植病研究方法[M].3 版.北京:中國農業出版社,1998. FANG Z D.Plant Disease Research Method[M].The third edition.Beijing:China Agricultural Press,1998.
[6] 李戌清,嚴建立,阮松林.三葉青炭疽病病原菌的鑒定與生物學特性[J].浙江農業學報,2020,32(11): 2009–2019. LI X Q,YAN J L,RUAN S L.Identification and biological characteristics of anthracnose pathogen on Tetrastigma hemsleyanum[J].Acta Agriculturae Zhejiangensis,2020,32(11):2009–2019.
SCISSCIAHCI