發(fā)布時間:2022-01-07所屬分類:農(nóng)業(yè)論文瀏覽:1次
摘 要: 摘要:以粉色馬蹄蓮塊莖芽、葉和植株為外植體MS 為基本培養(yǎng)基在加 NAA02mg/L+BA1~3mg/L 時 有利于叢芽和愈傷組織的誘導(dǎo)。在加 NAA 02~05mg/L+BA 05~1mg/L 時既有利于不定叢芽的分化誘導(dǎo)又利于不定芽的生長。在 BA 為02mg/L 時有利于不定芽的生長但對愈傷組織及不定
摘要:以粉色馬蹄蓮塊莖芽、葉和植株為外植體‚MS 為基本培養(yǎng)基‚在加 NAA0∙2mg/L+BA1~3mg/L 時‚ 有利于叢芽和愈傷組織的誘導(dǎo)。在加 NAA 0∙2~0∙5mg/L+BA 0∙5~1mg/L 時‚既有利于不定叢芽的分化誘導(dǎo)‚又利于不定芽的生長。在 BA 為0∙2mg/L 時‚有利于不定芽的生長‚但對愈傷組織及不定芽的誘導(dǎo)不利‚ 增殖系數(shù)低。高濃度 BA 有利于愈傷組織和芽的分化‚低濃度則對芽的生長有利。外植體葉和植株在各處理中無顯著差異‚特別是生長后期。葉組織在培養(yǎng)中大部分死亡‚只有極少部分產(chǎn)生愈傷組織。植株在培養(yǎng)過程中葉片逐漸變黃、枯死。
關(guān) 鍵 詞:彩色馬蹄蓮;組織培養(yǎng);愈傷組織
彩色馬蹄蓮(Zantedschina antedschina)是天南星科蔓綠絨亞科海芋屬7個種中除白花海芋( Z∙aethiop ica) 外 其 余 6 種 及 其 種 間 雜 交 種(Z∙antedschia hybrida)的總稱[1]。彩色馬蹄蓮生態(tài)習(xí)性不同于早已引種的馬蹄蓮 Z∙aethiop ica(L∙) K∙Spreng [2]‚彩色馬蹄蓮與冬季開花的白色馬蹄蓮的差別在于彩色馬蹄蓮營養(yǎng)體是球莖‚而白色馬蹄蓮的營養(yǎng)體是根莖。現(xiàn)有彩色馬蹄蓮品種是由6個野生 種 即 星 葉 點 白 花 馬 蹄 蓮 Z∙albomaculata (Hook)Bill、星葉點黃花馬蹄蓮 Z∙j ucunda Letty、黃花馬蹄蓮 Z∙elliottiana(Watson)Eng∙l 、香水馬蹄蓮 Z∙odorata P∙L∙Petty、黃金馬蹄蓮 Z∙pentlandii(Watson)Wittm∙‚粉紅馬蹄蓮 Z∙rehmannii Engl 雜交選育而成的[3]‚品種間的形態(tài)、花色和生長適應(yīng)性有明顯差別。彩色馬蹄蓮優(yōu)良品種的傳統(tǒng)繁殖只能采用分球方法‚而分球法一般需在休眠期進行‚繁殖周期長‚繁殖系數(shù)小‚因此‚很難滿足產(chǎn)業(yè)化生產(chǎn)的需要。近幾年來‚對馬蹄蓮的組織培養(yǎng)研究‚已經(jīng)成功獲得了組培苗[4-5]‚但是在培養(yǎng)過程中‚還存在污染率高‚繁殖系數(shù)較小‚生根效果不盡理想、移栽成活率不高等問題[6]。針對以上問題筆者對粉色馬蹄蓮組織培養(yǎng)快速繁殖的條件和方法進行研究‚為進一步工廠化快速繁殖彩色馬蹄蓮提供參考依據(jù)。
1 材料和方法
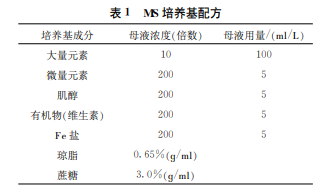
1∙1 實驗材料、試劑和儀器 實驗材料是粉色馬蹄蓮品種‚購買自中國農(nóng)業(yè)科學(xué)院。試劑和儀器為 MS 大量元素、MS 微量元素、MS 有機物類、MS 肌醇、MSFe 鹽、NAA、BA、酒精70%、瓊脂(粉狀)、蔗糖、氫氧化鈉、去離子水;高壓滅菌鍋、潔凈操作臺。
1∙2 實驗方法 (1)MS 培養(yǎng)基‚見表1。(2)不同組織培養(yǎng)基處理。芽誘導(dǎo)愈傷組織或幼芽培養(yǎng)基為8 個處理(MS+NAA0∙2mg/L+BA0∙2mg/L、MS+ NAA0∙2mg/L +BA0∙5mg/L 、MS + NAA0∙2 mg/L+BA 1∙0 mg/L、MS +NAA 0∙2 mg/L +BA 2∙0mg/L、MS +NAA 0∙5 mg/L +BA 1∙0 mg/L、 MS+NAA 0∙5 mg/L +BA 2∙0 mg/L、MS +NAA 0∙5mg/L+BA3∙0mg/L)。單芽誘導(dǎo)培養(yǎng)基3個處理(MS+NAA0∙1mg/L+BA1∙0mg/L、MS+NAA 0∙1mg/L+BA 2∙0mg/L、MS+NAA 0∙1mg/L+ BA3∙0mg/L)。(3)不同誘導(dǎo)培養(yǎng)6個處理(MS+ NAA0∙2mg/L +BA1∙0mg/L 、MS + NAA0∙2 mg/L+BA 2∙0 mg/L、MS +NAA 0∙2 mg/L +BA 3∙0mg/L、MS +NAA 0∙5 mg/L +BA 1∙0 mg/L、 MS+NAA 0∙5 mg/L +BA 2∙0mg/L、MS + NAA 0∙5mg/L+BA3∙0mg/L)。按常規(guī)方法消毒后接種在誘導(dǎo)培養(yǎng)基中。芽誘導(dǎo)愈傷組織或幼芽培養(yǎng)基每一處理重復(fù)8次‚單芽誘導(dǎo)培養(yǎng)基和不同外植體誘導(dǎo)培養(yǎng)每一處理重復(fù)5次。每瓶接4個小芽。培養(yǎng)基 pH 值為5∙8‚含蔗糖3%、瓊脂0∙65%。培養(yǎng)室溫度(25±1) ℃‚光照強度1600lx‚每天光照16h 環(huán)境條件下進行組織培養(yǎng)。每10d 調(diào)查1次‚調(diào)查材料接種后的污染情況、愈傷組織分化誘導(dǎo)情況、不同接種方式、不同培養(yǎng)基芽的分化數(shù)、相同培養(yǎng)基接種不同材料的長勢和死亡數(shù)等。
2 結(jié)果與分析
2∙1 不同 NAA 與 BA 的濃度比對愈傷組織的影響
對粉色馬蹄蓮芽眼誘導(dǎo)不同培養(yǎng)基上的死亡數(shù)相差不大‚說明培養(yǎng)基中激素濃度的差異對外植體死亡率的影響不大‚這可能是消毒不徹底或取芽塊時操作不當(dāng)造成的。隨著培養(yǎng)時間延長‚BA 濃度的增大植株的高度降低‚且顏色變淡‚NAA 為0∙5 mg/L 時‚植株顏色明顯變淡‚逐漸發(fā)白‚褐化現(xiàn)象嚴重。說明 NAA0∙2mg/L +BA0∙2~1∙0mg/L 較適合粉色馬蹄蓮苗的誘導(dǎo)培養(yǎng)。
從表2、3可以看出‚隨著培養(yǎng)時間延長‚BA 濃度的增大產(chǎn)生愈傷組織的芽塊數(shù)也隨著增多‚且差異較明顯;培養(yǎng)至50 d 時‚BA 濃度在1∙0~2∙0 mg/L 范圍內(nèi)產(chǎn)生愈傷組織的芽塊數(shù)反而高于 BA 為3∙0mg/L 時產(chǎn)生愈傷組織的芽塊數(shù)。在試驗中發(fā)現(xiàn)‚BA 濃度在1∙0~2∙0mg/L 范圍內(nèi)產(chǎn)生的愈傷組織不僅大而致密‚且有綠色芽點產(chǎn)生‚隨著時間的延長有少量的幼芽產(chǎn)生‚而 BA 為3∙0mg/L 時則很少。說明 MS+NAA 0∙2mg/L + BA 1∙0~ 2∙0mg/L 較適合粉色馬蹄蓮愈傷組織的誘導(dǎo)培養(yǎng)。 2∙2 BA濃度對單芽的誘導(dǎo)效果 將接種于三種培養(yǎng)基上的部分單芽切去葉片為對照‚部分分切成兩半‚分別接種于誘導(dǎo)培養(yǎng)基 NAA 0∙1+BA 1∙0、 NAA0∙1+BA2∙0和 NAA0∙1+BA3∙0。誘導(dǎo)培養(yǎng)結(jié)果見表4‚培養(yǎng)基 NAA 0∙1+BA 2∙0較 NAA 0∙1+BA 1∙0和 NAA 0∙1+BA 3∙0產(chǎn)生的叢芽多‚說明高濃度的 BA 較低濃度 BA 易誘導(dǎo)叢芽及愈傷組織產(chǎn)生‚單芽對半切較不切的更易誘導(dǎo)出叢芽及愈傷組織‚這可能是由于不分切的未打破頂端優(yōu)勢而促進叢生芽發(fā)生。
2∙3 不同外植體在相同條件下的誘導(dǎo)情況
在不同培養(yǎng)基中經(jīng)過50d 后‚誘導(dǎo)結(jié)果見表5。莖芽在培養(yǎng)基 NAA0∙5+BA2∙0中產(chǎn)生的叢芽及愈傷組織最多‚速 度 最 快;NAA 0∙5+BA 3∙0 其 次‚NAA 0∙5+BA1∙0中愈傷組織雖然產(chǎn)生也較多‚但是芽點較少‚且有畸形芽出現(xiàn);在 NAA0∙2+BA1∙0中‚產(chǎn)生的叢芽及愈傷組織均較少‚并且出現(xiàn)單株小苗。葉片和葉柄在幾種誘導(dǎo)愈傷組織的效果均較差‚大部分雖表現(xiàn)膨大‚但只有 NAA0∙2+BA3∙0、NAA0∙5+BA2∙0和 NAA0∙5+BA3∙0培養(yǎng)基上有一塊葉片和一個葉柄產(chǎn)生少量愈傷組織。培養(yǎng)后期‚大部分芽塊基部形成致密具綠色芽點的愈傷組織塊‚并有大量不定小芽長出‚部分長成植株‚較大的高達5cm。
3 討 論
從 NAA、BA 濃度對粉色馬蹄蓮愈傷組織誘導(dǎo)分 化 的 影 響 中 可 以 看 出‚NAA 0∙2 mg/L +BA 0∙2mg/L和 NAA0∙2mg/L+BA0∙5mg/L 的培養(yǎng)基上的不定芽長勢最佳‚形成植株‚且株高較高‚數(shù)目較少; NAA0∙2mg/L+BA 1∙0mg/L、NAA 0∙2mg/L+ BA 2∙0mg/L、NAA0∙5 mg/L +BA 1∙0 mg/L 和 NAA 0∙5mg/L+BA2∙0mg/L 的培養(yǎng)基上的不定芽形成植株株高較矮‚不定芽數(shù)目較多;這可能與 NAA0∙2mg/L+ BA0∙2mg/L 和NAA0∙2mg/L+BA0∙5mg/L 的培養(yǎng)基中 NAA 濃度偏低‚與 NAA、BA 比值偏高有關(guān)[7]。NAA 0∙5mg/L+BA1∙0mg/L、NAA0∙5mg/L+BA2∙0mg/L 和 NAA0∙5mg/L+BA3∙0mg/L 的培養(yǎng)基上的愈傷組織生長較弱‚質(zhì)地疏松‚基部褐化嚴重‚這可能主要是 NAA 濃度過高所致[9]。隨著濃度的升高‚生長素對植物器官伸長的促進作用增加‚并逐漸達到最大值;此時如果繼續(xù)增加生長素的濃度‚就會對植物的生長產(chǎn)生抑制作用[8]。因此在粉色馬蹄蓮愈傷組織增殖培養(yǎng)過程中‚NAA 的濃度最好不要高于 0∙2mg/L。
粉色馬蹄蓮快繁的最佳外植體為莖芽‚在實驗所用的培養(yǎng)基中全部成活‚且誘導(dǎo)出不同組織‚在實際生產(chǎn)中‚可根據(jù)需要選擇適當(dāng)?shù)呐囵B(yǎng)基‚可達到很好的效果。——論文作者:王進忠1‚高 文1‚高遐虹1‚馮 強1‚孫淑玲1‚張民照1‚于同泉2
參考文獻:
[1] 何陽修∙海芋之種類及栽培習(xí)性(三) [J]∙ 種苗快訊‚1994‚ (8):33-37
[2] 錢妙芬‚唐勝富‚毛 廉∙馬蹄蓮大棚小氣象適應(yīng)性評估[J]∙ 成都氣象學(xué)院學(xué)報‚1994‚9(3):67-71
[3] Singh Y‚Van Wyk A E∙Floral biology of Zantedeschia aethiopica (L∙) Spreng (Araceae) [J ]∙South African Journal of Botany‚1997‚62(3):146-150
[4] 吳麗芳‚熊 麗∙彩色馬蹄蓮組培研究[J]∙ 西南農(nóng)業(yè)大學(xué)學(xué)報‚1999(5):423-426
[5] 李 群∙熱水浴預(yù)處理對馬蹄蓮初代培養(yǎng)過程中污染的控制[J]∙四川師范大學(xué)學(xué)報‚2001‚5:520-521
[6] 李 群‚陳麗萍∙馬蹄蓮組培過程中真菌和細菌污染的消除方法研究[J]∙四川師范大學(xué)學(xué)報‚2001‚(6):607-609
[7] 譚文澄‚戴策剛∙觀賞植物組織培養(yǎng)技術(shù)[ M ]∙ 北京:中國林業(yè)出版社‚1991:370-371
[8] 崔德才‚徐培文∙植物組織培養(yǎng)與工廠化育苗[ M ]∙ 北京:化學(xué)工業(yè)出版社‚2004:25-26